Alla base della meccanica quantistica: il principio di indeterminazione di Heisenberg
Uno dei concetti che aprì a strada alla meccanica quantistica fu il principio di indeterminazione di Heisenberg, definito negli anni ’20 del ‘900. Deve il suo nome a Werner Karl Heisenberg, che nel 1932 ricevette il premio Nobel per la Fisica. Oggi è considerato a tutti gli effetti uno dei padri della meccanica quantistica, ma è ricordato anche per il suo contributo alle ricerche sulle armi nucleari.
Nel suo approccio all’atomo e alle particelle subatomiche questo scienziato si concentrò in particolare sul modello elaborato da Bohr. Volle approfondire i limiti di questa struttura atomica, soprattutto per quanto riguardava la descrizione degli orbitali. Bohr era infatti convinto di poter determinare con accuratezza posizione e velocità degli elettroni intorno al nucleo.
I concetti che portarono al principio di indeterminazione di Heisenberg
Prima di esaminare nel dettaglio questa legge della Fisica Quantistica dobbiamo prima richiamare le nozioni che portarono a definirla. Partiamo innanzitutto dal dualismo onda-particella, ovvero la duplice natura corpuscolare e ondulatoria della materia. Questo permette di considerare gli elettroni sia come particelle che come onde, così come i fotoni.
Nella formula che vedremo al paragrafo successivo e che descrive il principio di indeterminazione di Heisenberg inoltre compare la costante di Planck.
La indichiamo con il simbolo h e rappresenta la costante di proporzionalità fra l’energia e la frequenza posseduti da un fotone. A volte la si denomina quanto d’azione poiché rappresenta la più piccola quantità di energia trasferibile sotto forma di radiazione elettromagnetica.
Troviamo la costante di Planck anche all’interno dell’equazione di Schrödinger, nata per descrivere posizione e moto degli elettroni di un atomo. Il valore che le sè assegnato a livello del Sistema Internazionale delle unità di misura a è pari a 6,626 x 10-34 Js. La meccanica quantistica opera su una scala microscopica e il valore di h è l’unico sufficientemente piccolo per quantificare l’energia degli elettroni.
L’energia quantizzata infatti è un concetto che deriva dal fatto che ogni quantità di energia risulta multiplo di un’unità molto piccolo, per l’appunto h. Nell’atomo di Bohr il “quanto” di energia corrisponde alla radiazione elettromagnetica assorbita o rilasciata da un elettrone quando passa da un’orbita all’altra.
Enunciato e formula
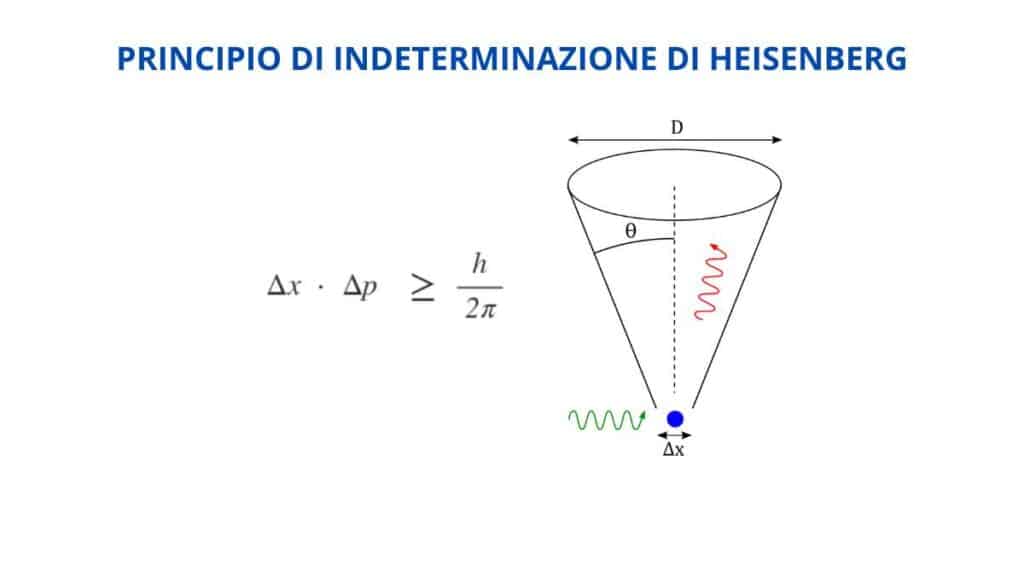
Vediamo ora di definire cosa afferma il principio di Heisenberg. Riassumendolo in parole povere possiamo dire che non è possibile misurare con accuratezza e quindi conoscere simultaneamente la posizione e la quantità di moto di un corpo. In modo più generico non si possono conoscere con precisione e in contemporanea i valori di due variabili coniugate.
Possiamo indicare le variabili indicate rispettivamente con x (posizione della particella) e p (quantità di moto della particella). Nella formula indichiamo le incertezze (o meglio gli errori) relative alle due variabili con Δx e Δp. La loro relazione deve rispettare la disuguaglianza Δx Δp ≥ 1/2 ℏ. In questo caso usiamo ℏ, che rappresenta la costante di Planck ridotta. La si ottiene dal rapporto fra h e 2π.
La relazione che vediamo nella formula esprime il principio di indeterminazione di Heisenberg. Definisce infatti che le loro misure avranno sempre un errore tale che il prodotto delle due incertezze sarà sempre maggiore o uguale a 1/2 ℏ. Ne ricaviamo che Δx e Δp fra di loro sono inversamente proporzionali: all’aumentare di una, l’altra diminuisce.
Inevitabilmente più si cerca la precisione per una delle due misure maggiore sarà l’errore dell’altra. Se Δx o Δp tendono a zero infatti l’altro errore aumenterà fino a un valore enorme, tenderà cioè all’infinito. Se invece cerchiamo di definire solo l’una o solo l’altra riusciremo ad avere maggiore accuratezza, ma sacrificando altre informazioni.
Il significato sperimentale del principio di indeterminazione di Heisenberg
In quanto la misura seguirebbe l’urto la posizione della particella sarebbe ormai completamente diversa da quella che aveva prima. Per quanto riguarda il fotone usato questo incontrando l’elettrone finirebbe con il deviare in modo casuale e non restituire perciò informazioni precise. Per di più bisogna considerare il raggio medio dell’orbita dell’elettrone, di ordine di grandezza 10-10.
Considerando un fotone con lunghezza d’onda pari a metà del raggio e la relativa frequenza avremo che la sua energia è pari a a circa 5 x 104 eV. Una quantità molto superiore all’energia necessaria per l’estrazione di un elettrone anche dall’orbitale più interno (1s), di quasi 3.000 volte inferiore. In qualsiasi livello energetico si trovi quindi l’elettrone uscirebbe del tutto dalla sua orbita urtando questo fotone.
Il principio di indeterminazione di Heisenberg dunque risulta confermato anche supponendo di eseguire in prima persona delle misure. tutto ciò che posso sapere sull’elettrone lo determina l’equazione di Schrödinger. Non ne descrive la posizione, ma il percorso.