Il modello atomico di Rutherford e il confronto con quello di Thomson
Dal punto di vista storico l’atomo di Rutherford e quello di Thomson sono stati elaborati a distanza di ben quattordici anni uno dall’altro. Tra di loro i due modelli atomici sono molto diversi: statico e disordinato l’uno quanto dinamico e ben organizzato l’altro. Eppure nessuno dei due arrivò a rispecchiare la struttura reale di un atomo, per quanto forse Rutherford ci andò più vicino.
Studiarli aiuta però a capire quali furono le tappe della ricerca per arrivare a elaborare il modello a orbitali e la configurazione elettronica degli atomi. Senza le basi gettate da questi due fisici anzi forse non si sarebbe mai riusciti a definirlo.
Il modello atomico di Thomson
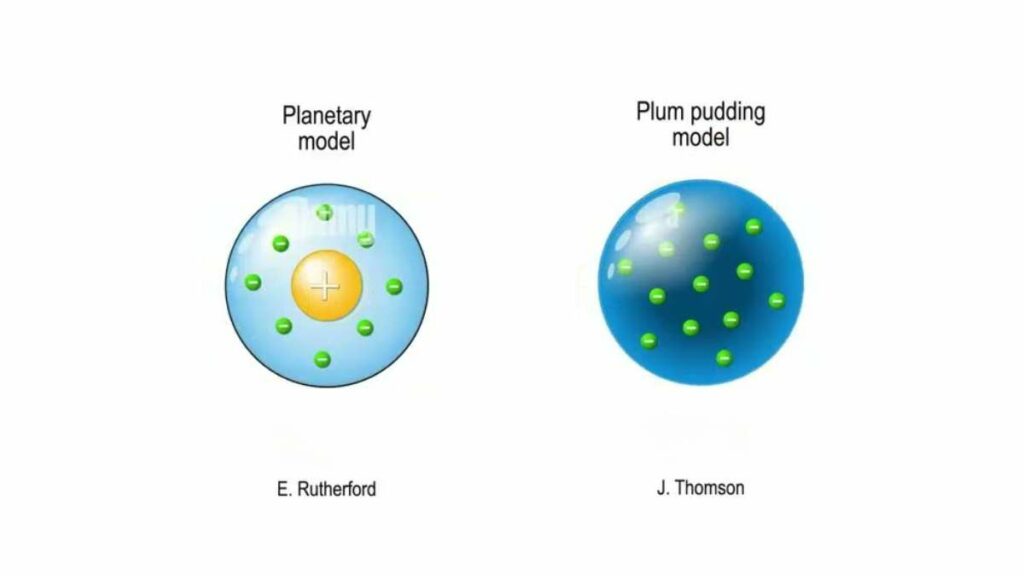
Tra i due atomi esaminiamo per primo quello che è tale dal punto di vista cronologico. Come riportano i libri di scuola per definirlo con una metafora venne chiamato anche plum pudding. La sua struttura ricordava quella del dolce inglese che di tradizione si prepara a Natale.
Il modello presentava l’atomo come una sfera carica positivamente che al proprio interno presentava come incastonati gli elettroni.
Thomson aveva identificato le particelle cariche negativamente ancora nel 1897, utilizzando il tubo progettato da Crookes. Aveva notato come queste fossero ben 1839 volte più piccole rispetto alla massa di un singolo atomo, ma non le chiamò elettroni bensì corpuscoli. Da qui dedusse che il resto della massa dovesse essere composto da una sostanza carica positivamente, in modo da neutralizzare le cariche negative.
L’atomo di Rutherford
Nel 1909 il fisico neozelandese Ernest Rutherford si procurò una sorgente di particelle α, ovvero nuclei positivi di elio. La orientò verso una sottile lamina d’oro (0,01 nm) all’interno di una zona delimitata da uno schermo fluorescente e poi la azionò. Grazie allo schermo poté rilevare la traiettoria seguita dalle particelle positive e proprio dalle direzioni che presero intuì che l’atomo in gran parte dovesse essere vuoto.
Mentre alcune delle particelle α rimbalzavano indietro come ci si sarebbe atteso dalla struttura di Thomson altre attraversavano la lamina. Questo indicava che ci fosse dello spazio libero nell’atomo, e che la carica positiva fosse concentrata in un punto preciso. Il fatto che alcuni nuclei di elio subissero delle deviazioni indicava che si fossero avvicinati alla parte positiva, ma senza colpirla in pieno.
L’atomo di Rutherford infatti fu il primo a ipotizzare un nucleo positivo, molto denso, attorno a cui ruotavano gli elettroni. Spesso ci si riferisce a questo modello atomico come planetario, poiché il fisico neozelandese lo elaborò immaginando una versione in scala ridotta del Sistema Solare.
Il nucleo al centro come il Sole e gli elettroni in movimento su orbite fisse come i pianeti.
Una struttura senza dubbio molto più simile a quella reale rispetto a Thomson, ma incompleta. Non forniva infatti informazioni sufficienti per capire quale fosse la posizione degli elettroni intorno al nucleo. Data la natura neutra degli elementi però il loro numero doveva essere tale da bilanciare la carica positiva.
I due modelli atomici a confronto
L’atomo di Rutherford e i dubbi chiariti da Bohr
Nel modello planetario l’elettrone descrive la sua orbita grazie all’equilibrio tra l’attrazione con il nucleo e la forza centrifuga, ma secondo l’elettromagnetismo c’è un problema di fondo. Una carica in movimento emette una radiazione elettromagnetica, dunque gli elettroni dovrebbero a poco a poco perdere la propria energia e precipitare sul nucleo.
La teoria del collasso elaborata da chi criticò questa struttura tuttavia era evidentemente falsa perché le particelle negative restavano sulle proprie orbite. La contraddizione dell’atomo di Rutherford sarebbe stata chiarita da Niels Bohr nel 1913 sfruttando il principio di Planck sulla quantizzazione dell’energia.