La funzione motrice delle miosine
Con il termine miosine indichiamo una famiglia di proteine molto numerosa, tanto che i polipeptidi che ne fanno parte sono riunite in più classi funzionali. Tra questa la classe II è quella che conosciamo meglio in quanto si tratta di proteine motrici presenti nelle fibre muscolari. Insieme all’actina, alla troponina e alla tropomiosina infatti compone le unità funzionali dei muscoli, i sarcomeri.
A consentire l’azione motrice di questi polipeptidi è l’energia chimica presente nel nostro corpo. Il loro spostamento infatti è mediato da molecole di ATP, una molecola composta da adenosina unita a tre gruppi fosfato. La si definisce spesso la “valuta energetica dell’organismo” e fornisce l’energia per diversi processi fisiologici e metabolici.
La struttura delle miosine
In natura esistono più di 18 classi di queste proteine, coinvolte in processi diverse. Per esempio la classe I raggruppa delle strutture peptidiche monomeriche coinvolte nel trasporto delle vescicole a livello cellulare. La classe numero III invece è presente nell’organismo modello Drosophila melanogaster e media la fototrasduzione, ossia la conversione della luce in stimolo nervoso.
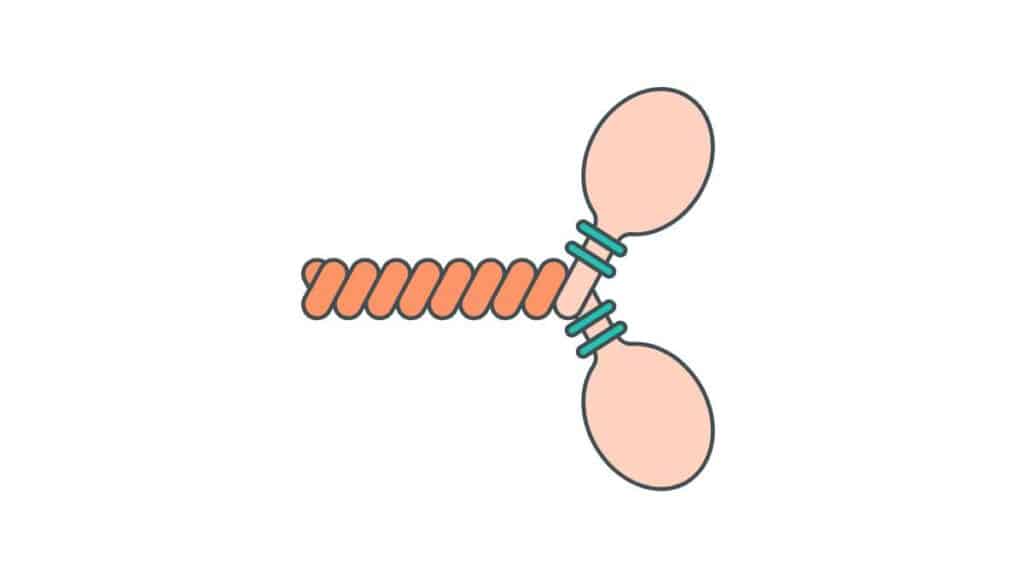
Veniamo alle miosine della classe II, ovvero quelle coinvolte nella contrazione muscolare non solo dell’essere umano ma di tutti gli animali. Le proteine appartenenti a questo gruppo dipende dall’interazione di più catene codificate da geni differenti e infatti esistono diverse isoforme. Tuttavia troviamo sempre due catene pesanti con una testa globulare e una coda sottile e fibrosa.
A queste due catene pesanti se ne legano altre quattro più leggere a livello del punto di raccordo tra la parte globulare e quella fibrosa. Per la precisione ognuno dei polipeptidi più grandi interagisce con due di quelli più corti. La coppia di peptidi più leggeri delle miosine non è formata da due molecole uguali, anzi li si distingue parlando di catena regolatrice e catena essenziale.
Nelle catene pesanti possiamo distinguere due domini, che si indicano con le sigle S1 e S2. Il primo è quello che compone le teste globulari e presenta sia i punti di legame per le molecole di actina che il sito attivo che può svolgere attività ATPasica. Invece il dominio S2 invece ha una forma a bastoncello e forma la parte sottile del polipeptide.
Il ruolo dell’ATP nella contrazione muscolare
L’adenosintrifosfato racchiude l’energia chimica nel legame fosfato-fosfato dei gruppi PO3 presenti nella sua struttura. Il rilascio di uno di questi gruppi fosfato libera una grande quantità di energia sufficiente a permettere la contrazione muscolare da parte delle miosine. L’ATP ha un sito di legame vicino a quello per l’actina sulla testa globulare e si unisce a livello dell’adenina.
Il movimento della miosina durante la contrazione muscolare si definisce “colpo di frusta” o “colpo di forza”. Consiste infatti in una specie di scatto in avanti di circa 10 nm lungo il filamento di actina che avviene una volta che l’ATP si scinde per idrolisi in ADP e un gruppo fosfato libero. Quando il legame tra i gruppi PO3 si rompe infatti la testa globulare della proteina si piega e al momento del rilascio del fosfato si sposta.
Quando l’ADP si stacca dal sito di legame con le miosine una nuova molecola di ATP arriva a rimpiazzarlo. Il nuovo legame riporta la testa globulare nella posizione di partenza. Questi spostamenti in avanti e indietro delle teste globulari di queste proteine corrispondono alla contrazione e al rilassamento dei muscoli.
Come accennato la miosina ha attività ATPasica e dunque non è necessaria la presenza di un enzima esterno. Tuttavia questa non è possibile se c’è scarso apporto di magnesio (Mg2+), di cui sappiamo che una carenza rende anche più soggetti ai crampi muscolari.
La forza generata dalle miosine
A questo livello il “colpo di frusta” descritto prima genera una forza che si stima intorno ai 3-4 pN (picoNewton). Il Newton (N) è l’unità di misura della forza e nel dettaglio 1 N corrisponde alla forza che riesce a imprimere a una massa pari a 1 kg l’accelerazione di 1 m/s2. Il prefisso pico- indica invece un sottomultiplo di questa unità: un pN equivale a 10−12 N.
Per arrivare a questo occorrono però dunque diversi miliardi di sarcomeri e quindi un numero enorme di miosine. Le unità contrattili si organizzano poi in miofibrille, ossia filamenti muscolari sottili che raggruppati vanno a costituire i muscoli scheletrici. In media una fibra muscolare contiene circa 1.000 miofibrille, ossia fibre di diametro inferiore formate da sarcomeri affiancati.
Le altre classi di proteine
Dopo aver analizzato la struttura delle miosine II vediamo di descrivere meglio gli altri elementi della stessa famiglia proteica. La miosina I, che come abbiamo accennato è composta da peptidi monomerici, ha una sola testa globulare anziché due. Tuttavia a sua volta ha due catene piccole legate vicino alla porzione globulare, diverse per sequenza amminoacidica da quelle della classe II.