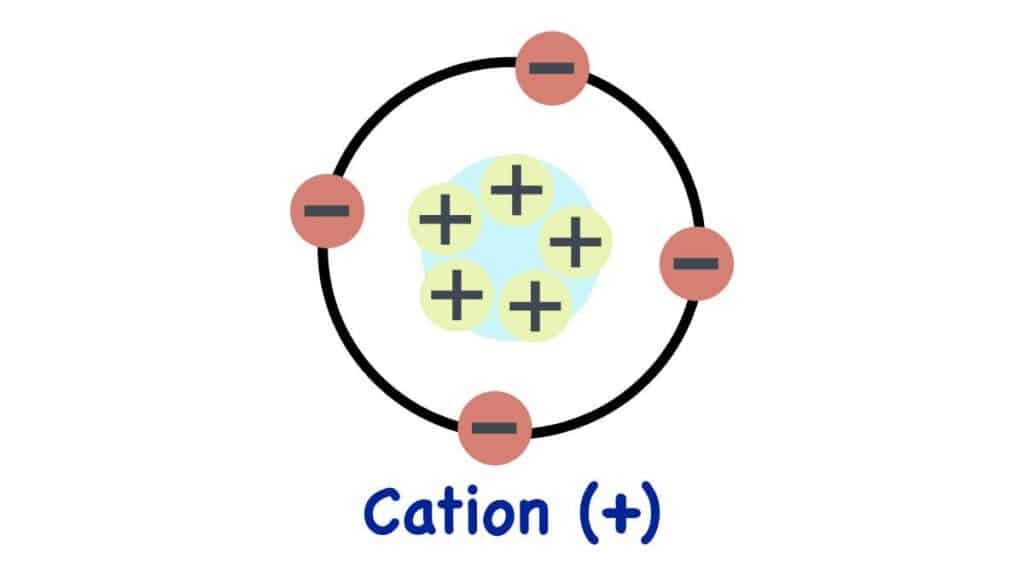
Cationi, gli ioni con carica elettrica positiva
Se abbiamo di fronte atomi o molecole dotati di carica positiva dobbiamo parlare di cationi. Siamo abituati a concepirli allo stato neutro, con gli elettroni e i protoni che si bilanciano perfettamente dato che sono presenti nello stesso numero. Quando però un composto o un elemento perde o acquista elettroni diventa uno ione.
Se gli elettroni vengono acquisiti otteniamo gli anioni, dotati di carica negativa. Viceversa rimuovendo uno o più elettroni da una molecola o un atomo creiamo la carica opposta, ossia quella positiva. Se i protoni superano in numero gli elettroni infatti è la loro carica a prevalere, perché non più schermata come era prima.
Come si indicano i cationi e quali reazioni li producono
Sappiamo che esistono due tipologie di ioni, ma qui ci dedicheremo a quelli dotati di carica positiva.
Riconoscerli quando compaiono all’interno di una reazione chimica non è difficile perché in alto a destra presentano il simbolo “+”. Questo può essere o meno accompagnato da un numero in base a quanti elettroni hanno perso l’atomo o la molecola.
Il più conosciuto dei cationi nonché il più semplice è H+, rilasciato dagli acidi forti in soluzione acquosa. Secondo la teoria acido-base di Bronsted-Lowry infatti si poteva capire se un composto fosse acido o basico in base al fatto che rilasciasse o acquistasse questo ione. Un altro esempio è l’elione (He2+), ovvero un nucleo “nudo” di elio.
Possiamo osservare degli ioni carichi positivamente quando si verifica la scissione di un sale. Prendiamo ad esempio il cloruro di sodio (NaCl) e facciamolo sciogliere in acqua. Questo si dividerà in due ioni, uno positivo e uno negativo, secondo la reazione NaCl => Na+ + Cl–.
Na e Cl infatti sono uniti da un legame ionico vista la marcata differenza di elettronegatività.
Un altro esempio è il solfuro di potassio (K2S), che è formato da due ioni K+ con carica positiva e un anione solfuro, ossia S2-. In natura troviamo abbondanza di ioni positivi all’interno delle nebulose, le nuvole di polveri e gas dove si formano le stelle. Questo perché le temperature elevate al suo interno riescono a ionizzare i gas.
La nomenclatura degli ioni positivi monoatomici
Dopo aver determinato come si creano e cosa sono bisogna capire come identificare i cationi. Dobbiamo fare una prima distinzione fra gli ioni positivi monoatomici e i poliatomici, formati da almeno due atomi. Partiamo dalla nomenclatura IUPAC, dove a regola prevede di ricavare il nome scrivendo semplicemente ione + il nome dell’elemento.
Partiamo dai monoatomici: se usiamo nomenclatura IUPAC è sufficiente scrivere ione + il nome dell’elemento. Se l’elemento ha più di un numero di ossidazione è necessario precisarlo fra parentesi tonde accanto al nome, usando i numeri romani. Per esempio Fe2+ è lo ione ferro (II), mentre Fe3+ è lo ione ferro (III). Oppure per il rame chiameremo Cu+ ione rame (I) e Cu2+ ione rame (II).
Passando alla nomenclatura tradizionale dei cationi, vediamo il caso con un solo numero di ossidazione. Si scrive ione + il nome dell’elemento + suffisso -ico. Quindi se prendiamo ad esempio Ca2+ diremo che è lo ione calcico. Se invece gli n.o. possibili sono due useremo il suffisso -oso per quello più basso di valore.
Come esempio consideriamo lo stagno, che può avere n.o. pari a +2 o a +4. Quindi possiamo chiamare Sn2+ lo ione stannoso e Sn+4 lo ione stannico. Oppure nel caso del ferro (Fe) avremo lo ione ferroso (Fe2+) e lo ione ferrico (Fe3+).
La nomenclatura dei cationi poliatomici
I nomi si assegnano seguendo lo schema ione + radice dell’elemento non metallico + suffisso -onio.
Possiamo citare come esempio di questi cationi quello che si produce dalla protonazione dell’acqua, ovvero H3O+. In questo caso si parla di ione ossonio dato che contiene ossigeno. Tuttavia lo si trova citato anche come ione idrossonio o idronio. Poi abbiamo anche H3S+, che presentando lo zolfo si chiama ione solfonio, e H2F+, ovvero lo ione fosfonio.
Un’eccezione a questa regola è rappresentata dal catione che rappresenta l’acido coniugato dell’ammoniaca, ovvero NH4+. Lo indichiamo con la denominazione di ione ammonio invece di usare la radice dell’elemento. Si trova anche nel nostro organismo e deriva dal catabolismo delle proteine.
Considerandoli insieme agli anioni poliatomici possiamo notare che queste specie chimiche derivano principalmente da acidi e basi, e ne rappresentano la forma coniugata. Si formano per la perdita o l’acquisizione di un atomo di idrogeno, quindi da sostanze che rispettano la regola di Brønsted-Lowry.