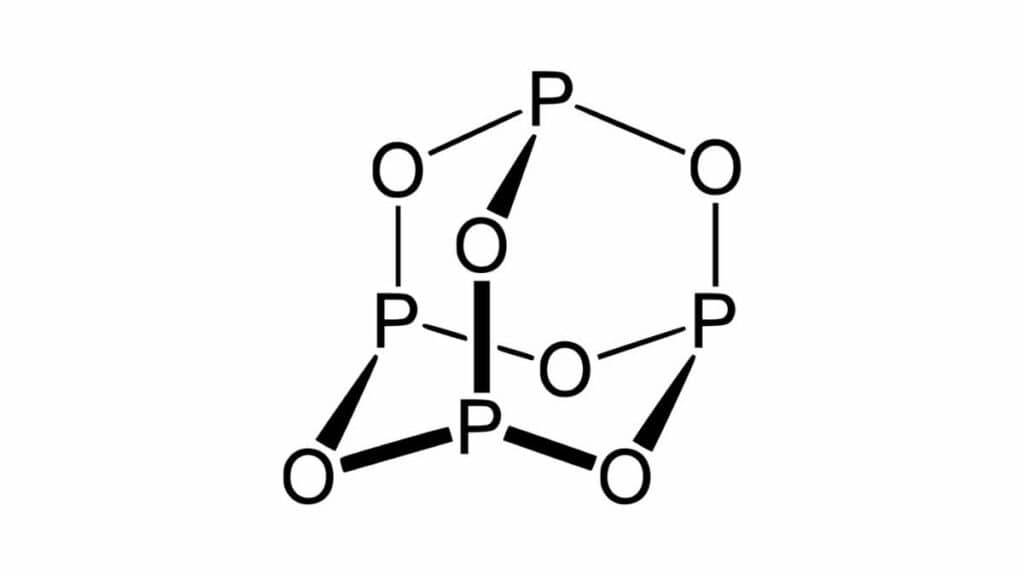
Formula e struttura dell'anidride fosforosa
Quando parliamo di anidride fosforosa intendiamo un composto binario contenente fosforo (P) e ossigeno (O) che in formula si scrive P4O6. Ciò nonostante si utilizza più spesso la formula minima, ovvero P2O3. In nomenclatura IUPAC quindi ci si riferisce a questo composto con il nome esaossido di tetrafosforo nel caso della prima formula, o triossido di difosforo per la seconda.
Nonostante quando parliamo di anidridi ci venga da pensare a sostanze gassose (es. CO2) a temperatura ambiente P4O6 è allo stato solido. Si mostra come una polvere fine di colore bianco che si può sciogliere in acqua. Reagendo con altre sostanze può produrre sostanze fondamentali per l’industria tessile o alimentare.
Come si ottiene l’anidride fosforosa
Come abbiamo accennato a circa 20° questo composto è allo stato solido, ma fonde a bassa temperatura (23,8 °C). Una volta diventato liquido arriva ad ebollizione alla temperatura di 175°C. Finché rimane nella forma di polvere la sua densità è di 2,14 g/cm3,circa il doppio rispetto all’acqua, e la sua massa molare è di 219,9 grammi.
Per ottenerla occorre una reazione di combustione del fosforo bianco, cioè P4 + 3O2 => P4O6. Perché la reazione vada a buon fine deve avvenire in un ambiente secco, privo del tutto di umidità, che renderebbe più difficile la combustione. Il fosforo bianco utilizzato per produrre l’anidride fosforosa è una sostanza molto pericolosa usata in ambito militare per bruciare i tessuti umani.
Il contatto tra questa polvere candida e l’aria provoca infatti la formazione della P4O6 che rapidamente si converte in P4O10 (P2O5) ovvero anidride fosforica. Una volta che questa sostanza tocca la pelle sudata si produce acido fosforico. che ha un grande capacità corrosiva sui tessuti organici. Bisogna quindi utilizzare attrezzature specifiche per non rischiare incidenti.
La struttura della molecola P4O6 è molto simile a quella del tetraedro formato dai quattro atomi di fosforo di P4. Immaginando questi atomi come i vertici del tetraedro gli ossigeni che si vanno a legare si presentano ciascuno a metà di uno degli spigoli del solido. Ogni P infatti è ibridato sp3, come nella molecola del metano.
La trasformazione in P4O10
Se rimane all’aria e alla luce per un po’ di tempo l’anidride solforosa si ossida in anidride solforica. In questa molecola infatti il numero di ossidazione di P non è più +3 ma + 5. Anche questo composto si mostra come una polvere molto fine di colore bianco a 20°C, in grado di assorbire rapidamente umidità. Non evapora sotto i 360°C, quindi è più stabile della P4O6.
La reazione che porta a ottenerla è la seguente: 5 P4O6 => 2 P4 + 6 P2O5. L’anidride fosforica è un reagente importante nell’industria perché si tratta di un composto con forte potere disidratante dato che assorbe facilmente l’acqua. Una delle reazioni in cui si impiega è la conversione delle ammidi in nitrili (gruppo funzionale −C≡N). Questi ultimi si adoperano per la produzione di particolari tipi di colla.
I nitrili sono anche alla base di un particolare tipo di gomma che si usa per i guanti da laboratorio (gomma nitrilica) per chi è allergico al lattice. Nella reazione la P4O10 ricavata dall’anidride fosforosa si aggiunge a un’ammide primaria o secondaria. Si ottiene così un nitrile e una forma idratata non ben definita della P4O10.
Le reazioni dell’anidride solforosa
Quando l’acqua è presente in rapporto 2 : 1 con il soluto allora l’anidride fosforosa si combina con il liquido secondo l’equazione di reazione P2O3 + H2O => 2 H4P2O5. Il prodotto è l’acido pirofosforoso, da non confondere con il pirofosforico che invece ha come formula H4P2O7. Infine quando il rapporto fra P2O3 e H2O diventa 1 : 3 allora produco H3PO3 (acido ortofosforoso o acido fosforoso).
Questo composto ternario a temperatura ambiente si trova sotto forma di cristalli trasparenti, ma è facilmente solubile in acqua. Riscaldando una soluzione acquosa in cui è stato disciolto dell’acido fosforoso aiuta a concentrarlo, perché è utile in alcuni procedimenti industriali. In particolare i fosfiti che si possono produrre miscelandolo con altri composti sono usati come stabilizzanti.
Dall’H3PO3 si può ricavare per esempio il fosfito piomboso (PbPO3) che aiuta a mantenere la struttura del cloruro di polivinile, una fibra sintetica. Può essere utilizzata sia come materiale di rivestimento dei cavi elettrici che per realizzare giocattoli o contenitori per cibi e bibite.