Teoria di Bronsted- Lowry: cosa significa e perché è importante in chimica
Nello studio di acidi e basi ci si imbatte presto nella teoria di Bronsted-Lowry, uno dei tre modelli enunciati per spiegare la natura di questi tipi di sostanze. Il primo in ordine temporale fu quello elaborato dal chimico svedese Svante August Arrhenius. Il secondo modello è quello che esamineremo di seguito, e infine ci fu quello di Lewis, il più completo e sostanzialmente il più corretto.
Gli scienziati Johannes Nicolaus Brønsted e Thomas Martin Lowry formularono la loro spiegazione di acidi e basi nel 1923. La novità rispetto alla teoria di Arrhenius fu l’introduzione del concetto di complementarietà fra queste sostanze, non menzionato da Arrhenius. Questo scienziato infatti le definì in modo indipendente l’una dall’altra.
Dal modello di Arrhenius a quello di Bronsted-Lowry
Le teoria di Arrhenius risale a quasi quarant’anni prima rispetto al secondo modello per definire acidi e basi, tanto che fu messa per iscritto nel 1884. Essa afferma che gli acidi sono sostanze che in soluzione acquosa liberano ioni H+, mentre le basi sono composti che in soluzione acquosa rilasciano ioni OH-. Se guardiamo all’acido cloridrico (HCl) e all’idrossido di sodio (NaOH) questa definizione regge.
Il problema è che con altre sostanze, che pure hanno natura acida o basica, il modello non si può applicare. Possiamo pensare all’ammoniaca, che come possiamo vedere dalla formula, ossia NH3, non può rilasciare ioni OH- ma è una base. Il modello di Bronsted-Lowry invece unì acido e base in un’unica definizione, affermando che fossero queste sostanze a determinarsi a vicenda.
La teoria del 1923 infatti afferma che l’acido è un composto in grado di cedere ioni H+, come quella di Arrhenius. La base però è la sostanza che risulta in grado di accettare questi ioni, anche se a volte si trova la definizione che riporta al posto di H+ la dicitura protoni. Ora sappiamo però che fra atomi si verifica solo uno scambio di elettroni, e non di protoni che rimangono fissi nel nucleo.
Sempre secondo questo modello il trasferimento dello ione H+ può avvenire solo quando sono presenti sia l’acido che la base nello stesso ambiente. Di fatto questo significa che per definire l’una o l’altra sostanza occorre per forza avere a disposizione quella che le è complementare. Pensiamo per esempio all’ammoniaca in acqua: la prima agisce come base, la seconda come acido cedendo un H+ e formando lo ione ammonio (NH4+).
Le coppie acido-base coniugata
Se la teoria di Bronsted-Lowry afferma che acido e base devono stare a contatto per determinarsi, la definizione vista prima non precisa il seguito. Vale a dire che non spiega cosa diventino l’acido che cede lo ione H+ e la base che lo riceve una volta che la reazione è terminata. La risposta è che si trasformano nei rispettivi base e acido coniugati.
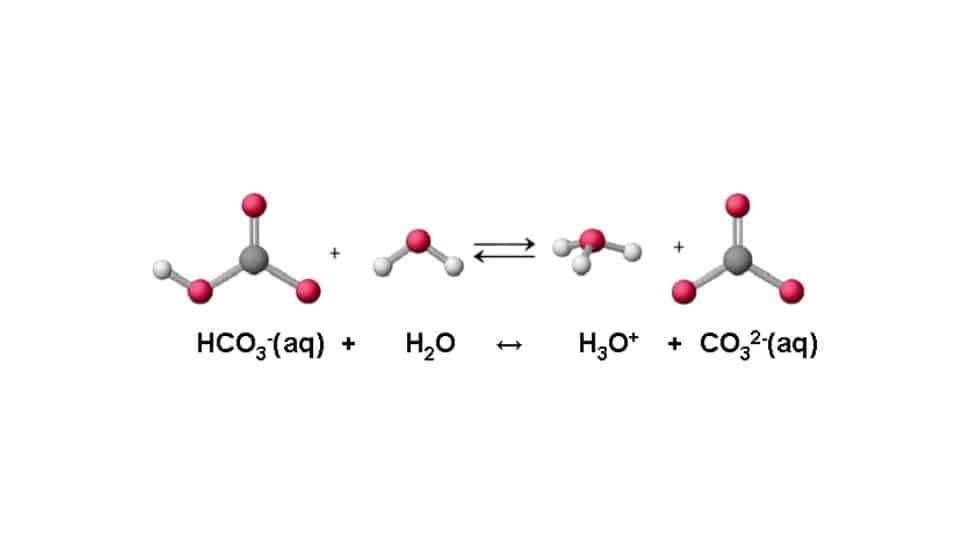
Per la precisione l’acido diventa una base coniugata, e la base un acido coniugato. Possiamo fare un esempio prendendo la reazione che avviene fra una acido forte come l’HCl e l’acqua (H2O). Vediamo che HCl + H2O <=> H3O⁺ + Cl-. Lo ione idronio (H3O⁺) è l’acido coniugato dell’acqua, che qui si comporta da base. Mentre il Cl- è la base coniugata dell’acido cloridrico.
Se vogliamo scrivere in modo generale questa implicazione del modello di Bronsted-Lowry possiamo usare la formula che segue. Indichiamo con HA un acido generico e con B una base generica. La reazione fra acido e base è perciò HA + B <=> A- + HB+. A- rappresenta la base coniugata, e HB+ l’acido coniugato, sempre in forma generica.
Nel caso dell’acqua, che è una sostanza anfotera, si imparano a memoria le forme acido e base coniugata che assume nelle reazioni. Se reagisce con un acido accetta un H+ e diventa H3O⁺, mentre con una base cede uno ione e diventa lo ione idrossido, ossia OH-.
Perché il modello di Bronsted-Lowry non è completo
L’unica teoria acido-base in grado di spiegare queste reazioni la definì Gilbert Newton Lewis, lo stesso scienziato che sviluppò la regola dell’ottetto per gli orbitali atomici. Secondo il suo modello a differenza da quello di Bronsted-Lowry sono le basi a trasferire qualcosa agli acidi, ossia un doppietto elettronico. Gli acidi quindi sono le sostanze in grado di accettare una coppia di elettroni fornito da una base.
Di fatto si tratta di una definizione simile a quella di Bronsted e Lowry, ma che appare rovesciata dato che solo gli elettroni si possono scambiare fra i composti. In più la presunta capacità della base di accettare il protone dipendeva dalla presenza di un doppietto elettronico libero, che le conferisce una parziale carica negativa. Invece di fargli guadagnare un protone però è questa a spostarsi.