Regola di Huckel: chiave per aromaticità e stabilità
Capire se un anello è stabile o “strano” può cambiare un esercizio d’esame. Spesso basta contare pochi elettroni e osservare la forma della molecola. Sembra magia, ma è chimica.
In chimica organica, l’idea di aromaticità nasce per spiegare stabilità insolite. Alcuni composti resistono a reazioni che “dovrebbero” avvenire. Altri, invece, diventano molto reattivi se forzati in geometrie particolari. In questo contesto entra la regola di Huckel, un criterio rapido basato sugli elettroni π. La userai per decidere se un sistema ciclico e coniugato è aromatico, antiaromatico o non aromatico.
Questo tema conta perché collega struttura, energia e meccanismi. Ti aiuta a prevedere addizioni elettrofile, sostituzioni e acidità. Inoltre riduce errori comuni, come confondere un anello “con doppi legami” con un anello davvero aromatico.
Nei prossimi punti vedrai quando si applica il criterio, quali condizioni geometriche servono e come contare gli elettroni. Useremo esempi concreti: benzene, ione ciclopentadienile e ione ciclopropenile. Infine chiariremo casi limite e trucchi pratici per gli esercizi.
Condizioni della regola di Huckel: ciclo e planarità
La regola di Huckel funziona solo se il sistema ha requisiti strutturali precisi. Prima di contare elettroni, verifica tre condizioni: anello, coniugazione continua e planarità. Se manca anche una sola, la previsione può fallire.
Un sistema è coniugato quando ogni atomo dell’anello ha un orbitale p disponibile. Questo avviene con atomi sp2 o con un carbocatione o carbanione in grado di allinearsi. La planarità serve per sovrapporre gli orbitali p. Se l’anello si piega, la sovrapposizione si riduce e l’aromaticità svanisce.
Esempio: il cicloottatetraene
\[\ce{C8H8}\]
Ha 8 elettroni c0, quindi sembrerebbe “antiaromatico”. Però non è planare: assume una forma a vasca.
Così interrompe la sovrapposizione e diventa non aromatico, più stabile del previsto. Al contrario, il benzene resta planare e coniugato, e quindi sfrutta pienamente la delocalizzazione.
Un controllo rapido negli esercizi: cerca un anello, poi controlla se ogni vertice può contribuire con un p. Infine chiediti se la molecola può essere piatta senza forte tensione. Solo dopo ha senso applicare il conteggio degli elettroni.
Regola di Huckel: contare elettroni π correttamente
Quando le condizioni strutturali sono soddisfatte, entra il conteggio. La regola di Huckel identifica come aromatici i sistemi ciclici con c0 elettroni pari a
\[(4n+2)\] con \(n = 0,1,2,\dots\).
Invece i sistemi con \[4n\] elettroni c0, se planari e coniugati, tendono a essere antiaromatici.
Per contare, somma gli elettroni nei doppi legami (2 ciascuno) e poi valuta cariche e coppie solitarie. Un anione in un orbitale p può contribuire con 2 elettroni.
Un catione, invece, contribuisce con 0, perché ha un p vuoto. Le coppie solitarie su eteroatomi contano solo se orientate nel sistema c0, non se restano in un orbitale ibrido.
Esempio numerico: lo ione ciclopentadienile
\[\ce{C5H5^-}\] ha due doppi legami (4 elettroni) e una carica negativa che aggiunge 2 elettroni nel p.
Totale 6, cioè \(4\times1+2\). Risulta aromatico e insolitamente stabile.
Questo spiega perché il ciclopentadiene è molto più acido di un alcene comune: la base coniugata è aromaticamente stabilizzata.
I passaggi da ricordare sono semplici: fai prima l’inventario degli elettroni c0, poi confronta con \(4n+2\). Se i conti tornano e la geometria regge, la previsione è affidabile.
Esempi di regola di Huckel: benzene e ioni
Alcuni esempi classici fissano le idee e tornano spesso nei test.
Sono piccoli, ma mostrano tutte le regole operative. Inoltre chiariscono perché la stabilità non dipende solo dal numero di doppi legami.
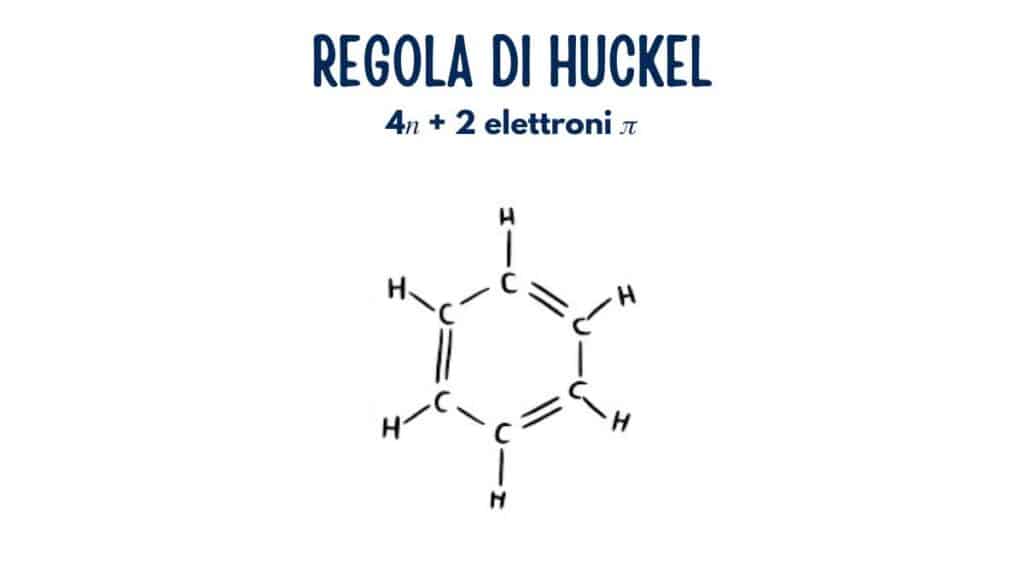
Il benzene \[\ce{C6H6}\] ha 6 elettroni c0 da tre doppi legami.
È planare e completamente coniugato. Per questo reagisce per sostituzione elettrofila aromatica e non per addizione semplice.
Lo ione ciclopropenile \[\ce{C3H3^+}\] ha 2 elettroni c0 (un doppio legame) e un p vuoto sul carbonio cationico. Totale 2, cioè \(4\times0+2\). Nonostante la tensione dell’anello a tre, è aromatico e stabilizzato.
Ecco i segnali pratici da riconoscere negli esercizi:
- Anello planare con p continui su ogni atomo
- Conteggio c0 che dà \(2,6,10,14\) elettroni
- Carica negativa spesso “vale” 2 elettroni c0
- Carica positiva spesso “vale” 0 elettroni c0
Infine, lo ione ciclopentadienile è l’altro pilastro: 6 elettroni c0 e grande delocalizzazione.
Vedere questi tre casi insieme aiuta a evitare un errore tipico: pensare che “più doppi legami” significhi automaticamente più aromaticità. Qui vince la combinazione tra geometria e conteggio.
Casi limite e trappole comuni: antiaromaticità e non aromaticità
Molti errori nascono quando si applica la regola di Huckel in modo meccanico. Il punto chiave è distinguere tra antiaromatico e non aromatico. Entrambi non sono aromatici, ma hanno cause e conseguenze diverse.
Un composto antiaromatico è planare, ciclico e coniugato, ma ha \[4n\]
elettroni c0. Questo aumenta l’energia e rende il sistema instabile.
Esempio: il ciclobutadiene \[\ce{C4H4}\] ha 4 elettroni c0.
Se fosse planare e perfettamente coniugato, sarebbe antiaromatico. Infatti è altamente reattivo e si osserva solo in condizioni controllate.
Un composto non aromatico, invece, “sfugge” alla definizione.
Può essere non planare o non completamente coniugato. Il cicloottatetraene è un buon esempio: ha 8 elettroni c0, ma evita l’antiaromaticità deformandosi. Un’altra trappola riguarda gli eteroatomi. In un anello tipo piridina, la coppia solitaria dell’azoto non entra nel sistema c0. In un anello tipo pirrolo, invece, la coppia solitaria contribuisce con 2 elettroni.
Il consiglio operativo è verificare sempre la “posizione” delle coppie solitarie e la possibilità reale di planarità. Se l’anello non può essere piatto, non forzare il conteggio. In quel caso la regola perde potere predittivo.
Metodo rapido per esercizi ed esami: una checklist in 60 secondi
Nei compiti a tempo serve un metodo breve e ripetibile.
La regola di Huckel diventa davvero utile quando la trasformi in una sequenza di controlli. Così riduci i dubbi e spieghi bene il ragionamento.
Passo 1: identifica il ciclo e segna ogni atomo potenzialmente sp2.
Passo 2: cerca interruzioni di coniugazione, come carboni sp3 senza p disponibile.
Passo 3: valuta se la molecola può essere planare senza troppa tensione.
Passo 4: conta gli elettroni c0 includendo cariche e coppie solitarie “giuste”. Infine confronta con \[(4n+2)\] o \[4n\].
Scenario tipico: ti danno un anello a cinque con due doppi legami e una carica negativa. In 20 secondi trovi 4 elettroni dai doppi legami, poi aggiungi 2 dalla carica. Arrivi a 6, quindi aromatico.
Se invece la carica fosse positiva, il totale resterebbe 4 e, se planare, sarebbe antiaromatico. A quel punto puoi prevedere maggiore reattività o instabilità.
Per collegare teoria e definizioni, torna utile ripassare il concetto di Aromaticità come proprietà energetica e strutturale.
La checklist ti permette anche di motivare risposte aperte, non solo di “indovinare” il risultato. Con un po’ di pratica, diventa un automatismo affidabile.
In sintesi: riconoscere i sistemi aromatici con sicurezza
La regola di Huckel funziona bene quando rispetti l’ordine dei controlli.
Prima verifica anello, coniugazione continua e planarità. Poi conta gli elettroni includendo cariche e coppie solitarie corrette. Infine confronta con \(4n+2\) per l’aromaticità o con \(4n\) per l’antiaromaticità.
Gli esempi chiave chiariscono il quadro.
Il benzene è aromatico e tende alla sostituzione, non all’addizione. Lo ione ciclopropenile mostra che anche anelli piccoli possono essere aromatici. Lo ione ciclopentadienile spiega stabilità e acidità grazie alla delocalizzazione.
Dall’altra parte, ciclobutadiene e simili evidenziano perché i sistemi \(4n\) sono spesso instabili. Altri esempi includono il naftalene, che è un composto policiclico aromatico, e il pirrolo, dove l’eteroatomo contribuisce alla delocalizzazione elettronica.
Questi casi dimostrano come l’aromaticità possa influenzare le proprietà chimiche e fisiche delle molecole.
Se stai preparando esercizi o un esame di chimica, applica sempre la checklist: geometria prima, elettroni dopo.
Se vuoi consolidare, prova a classificare 10 strutture diverse e giustifica ogni scelta in due frasi. Con questo approccio, la regola diventa uno strumento pratico e non una formula da memoria. Inoltre, confrontare strutture simili, come il furan e il tiofene, può aiutarti a comprendere l’impatto degli atomi diversi sull’aromaticità.