Proteine ed enzimi: guida con struttura e funzione
Quando si studiano i nutrienti e le macromolecole biologiche lo spazio dedicato alle proteine è molto vasto perché hanno diversi ruoli nel metabolismo. Soprattutto quando si tratta degli enzimi, peptidi catalizzatori che sono fondamentali per i processi vitali degli organismi.
La prima cosa da sapere è che la forma di questi polimeri biologici è già il loro biglietto da visita. Le proteine hanno quattro diverse strutture, che differiscono per organizzazione e complessità. Di seguito le analizzeremo.
Che cosa sono le proteine?
Nella cellula le proteine sono ricavate dal meccanismo della traduzione o sintesi proteica. A livello dei ribosomi arrivano le molecole di RNA messaggero con le triplette di basi che vengono “lette”. Per ciascuna il ribosoma richiama tramite i tRNA la sequenza complementare e l’amminoacido corrispondente.
Ogni proteina inizia con la metionina corrispondente alla sequenza di inizio di lettura o codone di inizio (nel DNA è AUG). Questa poi viene rimossa una volta che la catena amminoacidica risulta completa e non fa quindi parte della struttura finale del peptide. Gli amminoacidi esistenti in natura sono in tutto 20 e si dividono in essenziali e non essenziali.
Mentre i primi devono essere per forza assunti con la dieta perché il corpo non è in grado di sintetizzarli (in tutto sono otto). Per la precisione si tratta di lisina, leucina, valina, isoleucina, fenilalanina, treonina, metionina e triptofano. Gli altri invece possono essere prodotti dall’organismo attraverso le vie del metabolismo.
Struttura primaria e secondaria
Le proteine si possono organizzare in quattro tipi di strutture diversi. Il meno articolato è quella della struttura primaria, detta anche lineare. Si tratta semplicemente dell’allineamento degli amminoacidi che compongono il peptide. Si può considerare anche lo scheletro della proteina.
Il legame che li unisce si forma tra il gruppo carbossilico di un amminoacido e il gruppo amminico di quello adiacente. Nella sequenza si alternano a livello centrale due atomi di carbonio con uno di azoto. La struttura primaria è fondamentale perché la sequenza dei suoi amminoacidi determina le sue funzioni biologiche.
Più complessa è la struttura secondaria delle proteine, che invece prevede dei ripiegamenti della precedente. Anziché restare allineati gli amminoacidi interagiscono formando dei legami idrogeno che possono dare origine a due “forme diverse”. Vale a dire la struttura alfa-elica e quella a beta-foglietto ripiegato.
La prima come dice il nome stesso sistema le unità amminoacidiche secondo uno schema elicoidale (elica singola, non doppia come il DNA). I legami si formano fra amminoacidi vicini nella struttura lineare. La seconda invece unisce due tratti della catena degli amminoacidi e invece ricorda più una disposizione a fisarmonica.
Struttura terziaria e quaternaria delle proteine
Alla struttura terziaria delle proteine contribuiscono anche altre interazioni, come le forze di Van der Waals e i legami ionici. Questi nascono fra i gruppi NH3+ e i COO- degli amminoacidi della catena. Il ripiegamento del polipeptide a formare la struttura terziaria viene chiamato protein folding.
Un livello ulteriore e più complesso di organizzazione lo offre la struttura quaternaria che si forma per l’unione di più molecole proteiche fra di loro. Ognuna di queste è organizzata in una forma tridimensionale e viene detta subunità. Le interazioni fra le subunità sono deboli e questa organizzazione è facilmente denaturabile.
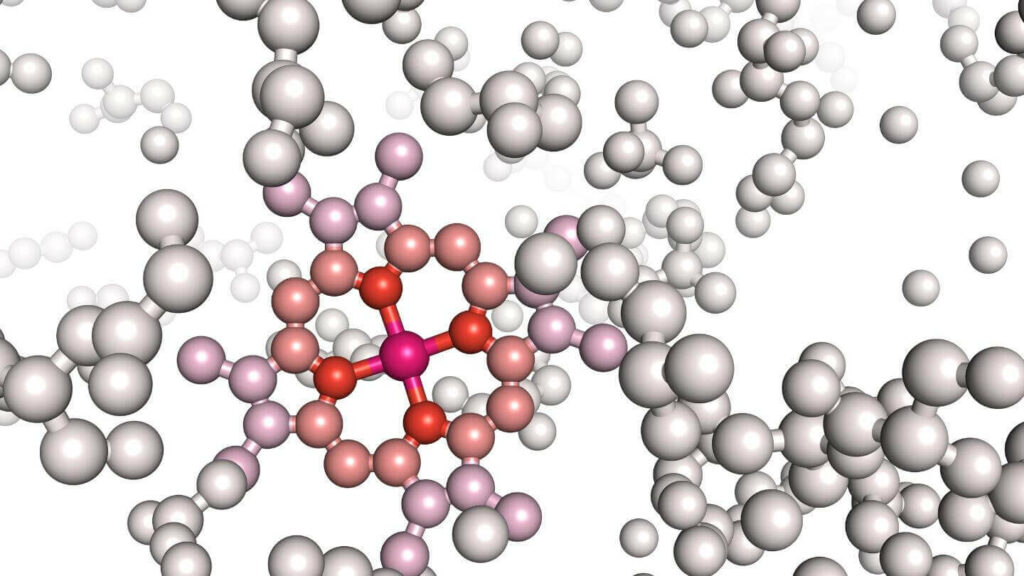
Tra le proteine con una struttura quaternaria si può citare l’emoglobina. Si compone infatti di quattro subunità, ciascuna delle quali presenta un gruppo eme contenente un atomo di ferro nella sua forma ossidata Fe2+. Grazie alla presenza di questo ione l’emoglobina è in grado di legare l’ossigeno presente nel sangue.