Nel nostro quotidiano tendiamo ad usare tanti oggetti che sono formati da atomi: basti pensare agli orecchini d’argento o d’oro oppure a chiodi in ferro.
Qualsiasi materiale con cui abbiamo un contatto fisico sono costituiti da queste piccolissime particelle chiamati Atomi.
Data l’importanza degli stessi, è fondamentale capire quali sono le 5 cose da sapere sull’atomo per il Test di ammissione alle facoltà di fisica, matematica, chimica etc.
L’Atomo: che cos’è?
L’Atomo è un’unità che fa parte della struttura di un qualsiasi oggetto, ed è la parte più piccola di un elemento: non subisce alterazioni nelle trasformazioni chimiche, ma solo alterazioni fisiche.
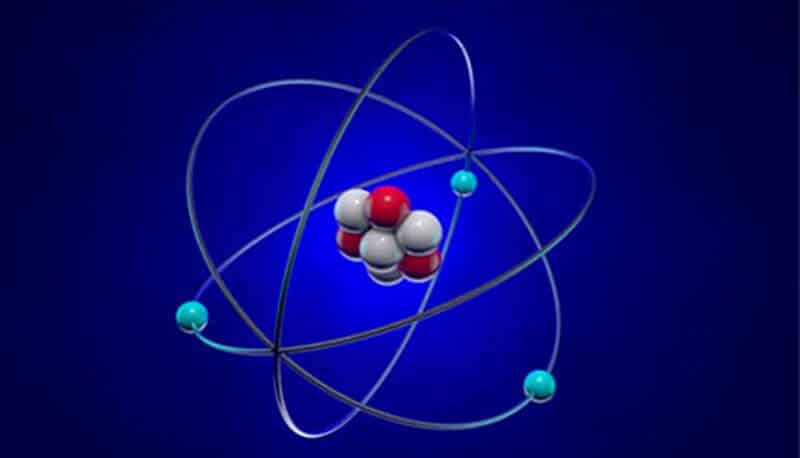
Al centro è costituito dal nucleo in cui vi sono i protoni, cariche positive e i neutroni, che non hanno alcuna carica. Intorno al nucleo ci sono gli elettroni che hanno una carica negativa.
Ogni atomo deve essere neutro: la differenza che intercorre tra il numero della massa e quello atomico determinerà i neutroni che sono presenti nel nucleo.
Si definiscono due quantità per identificare ogni atomo:
- Numero atomico (Z): il numero dei protoni presenti nel nucleo, che, allo stato neutro, corrisponde al numero di elettroni esterni ad esso;
- Numero di massa (A): la somma del numero di neutroni e protoni nel nucleo.
La teoria dell’atomo Dalton
La teoria dell’atomo è legata a una delle scoperte scientifiche più importanti.
Durante i primi anni risalenti al 1801, l’inglese Dalton propose una teoria sulla materia, i cui principi sono validi ancora oggi:
- la materia è costituita da piccolissime particelle, che si chiamano atomi;
- gli atomi non si possono creare, non si possono dividere o trasformare;
- gli atomi che fanno parte di un unico elemento sono sempre uguali;
- gli atomi che stanno in diversi elementi hanno differenti masse e possono combinarsi tra di loro attraverso dei numeri formando dei composti;
- nelle reazioni chimiche li atomi non si creano e non si distruggono.
Atomo: altri Modelli
Oltre a Dalton e alla sua teoria, Joseph John Thomson descrisse l’atomo in modo differente.
Secondo il fisico britannico l’atomo è costituito da una distribuzione di carica positiva diffusa all’interno della quale sono inserite le cariche negative.
Secondo questo modello l’atomo dunque sarebbe sostanzialmente pieno.
Questa teoria era inadeguata per Rutherford: secondo lo stesso l’atomo ha un piccolissimo nucleo denso in cui all’interno è contenuto il 90% di massa.
Il modello di Bohr, proposto per l’atomo di idrogeno, ottenne degli eccellenti risultati, coincidenti con lo spettro sperimentale.