Prolina: struttura, funzioni e importanza per il collagene
Tra gli amminoacidi non essenziali, ovvero quelli che il nostro corpo è in grado di sintetizzare, troviamo la prolina. Si tratta di una molecola apolare che si può produrre partire dai derivati del glutammato una volta che vanno incontro a ciclizzazione. Ne sono ricchi diversi alimenti sia di origine animale che vegetale, come i derivati del latte, le uova, i fagioli di soia e i legumi in generale.
La peculiarità di questa molecola organica è la sua struttura che gli conferisce una rigidità superiore agli altri amminoacidi. Lo troviamo come componente del collagene, una proteina abbondante nel tessuto connettivo e in particolate nella cute, nelle ossa e nei tendini. Con l’età ne produciamo sempre meno, e questi tessuti perdono gradualmente elasticità.
La struttura molecolare del collagene
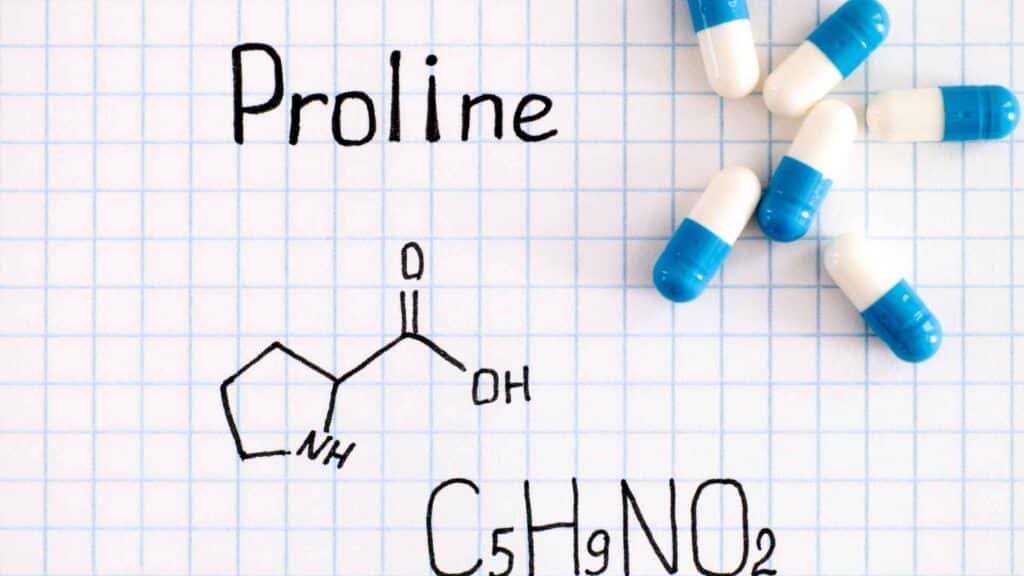
Partiamo dalla formula bruta di questo amminoacido, ossia C5H9NO2. Presenta un anello eterociclico a cinque atomi con quattro atomi di carbonio e uno di azoto, e la sua denominazione IUPAC precisa è acido 2(S)-pirrolidincarbossilico. Ha un centro chirale a livello del carbonio in posizione 2 e quindi ha due enantiomeri (L e D), ossia due isomeri ottici.
Nella struttura del collagene come di altre proteine troviamo però solo un enantiomeri, ovvero la L-prolina, l’isomero biologicamente attivo. Nel corpo umano la sua biosintesi parte dal glutammato e si articola in quattro fasi. Per cominciare questo reagisce con ATP formando il γ-glutammil fosfato grazie alla presenza dell’enzima glutammato chinasi.
Questa molecola subisce una riduzione da parte della γ-glutammil fosfato reduttasi diventando glutammato γ-semialdeide, passaggio in cui perde il gruppo fosfato ottenuto dall’ATP. Come cofattore questo enzima utilizza l’NADPH, che cede l’idrogeno per ridurre il substrato e si ossida diventando NADP. Il prodotto così ottenuto ciclizza in modo spontaneo formando un altro intermedio di reazione (Δ1-pirrolina-5-carbossilato).
Proprietà fisiche e chimiche
Vediamo ora di andare oltre la struttura della prolina osservando il suo comportamento in soluzione. Trattandosi di un acido carbossilico ha una pK1 abbastanza alta, pari a 1,95, ed è facilmente solubile in acqua (la solubilità è pari a 1500 g su litro). Se pura si presenta sotto forma di cristalli di colore chiaro, e la sua temperatura di fusione è di 220°C.
Per quanto riguarda la sua assimilazione, la assorbiamo a livello intestinale. Ci possono essere problemi di assimilazione in alcune circostanze, come ad esempio quando ci si sta sottoponendo a una cura di antibiotici o se si sono assunte bevande alcoliche. Una dieta bilanciata dovrebbe prevedere circa 1 grammo di prolina al giorno.
Nel nostro organismo troviamo la prolina in una forma modificata chiamata idrossiprolina, dove alla catena laterale si aggiunge un gruppo -OH. Questa forma è abbondane nel collagene, per la precisione un 13-15% della sua struttura. La si sintetizza a partire dall’amminoacido in presenza di vitamina C e dell’enzima prolil-idrossilasi.
Per formare il collagene l’amminoacido nella sua forma normale si combina con l’idrossiprolina e altre molecole come la glicina. Ne risulta una proteina con forma a tripla elica, dove troviamo questi tre elementi ripetuti legati ad altri amminoacidi che possono variare. Nel nostro corpo il collagene rappresenta circa il 25% delle proteine totali e il 6% del nostro peso.
Le funzioni del collagene
Non a caso si consiglia l’assunzione nella dieta di collagene per distendere la pelle e renderla più morbida ed elastica oltre che più luminosa. Prendere integratori a base di questa proteina porta beneficio anche ai capelli: ne previene la caduta, ritarda la loro perdita di colore e rende la chioma luminosa e morbida. Lo stesso vale per un altro annesso cutaneo, ossia le unghie.
Ci sono in commercio anche integratori a base di prolina, rivolti in particolare a chi segue una dieta vegana ed è più soggetto a una sua carenza. Una scarsa produzione di collagene o la mancanza di questo amminoacido può portare anche a problemi alle articolazioni. Il collagene infatti aiuta anche a mantenere elastici i tendini ed è importante per chi svolge una carriera sportiva.
Nel nostro organismo aumenta infatti la sintesi di idrossiprolina se si svolge esercizio fisico prolungato, ovvero sport di resistenza come il ciclismo o le maratone. Un utilizzo eccessivo di integratori però può portare a problemi a livello renale o del fegato a causa dell’eccessiva assunzione di azoto.
L’iperprolinemia congenita: quando la prolina è troppa
Esiste un raro disordine metabolico determinato da condizioni genetiche che porta a delle anomalie nel processo metabolico che produce questo amminoacido. La conseguenza principale è un aumento della sua concentrazione a livello ematico, ma la malattia può presentarsi in due forme: iperprolinemia I e II. Le indichiamo in ambito clinico con gli acronimi HPI e HPII.
La forma I porta alla comparsa di disturbi neuro-psichiatrici già in età infantile. Tra i sintomi troviamo una scarsa reattività da parte del bambino oltre a riflessi neonatali lenti e dismorfia a livello del volto. Nel caso dell’HPI il problema è un deficit dell’enzima prolina ossidasi, mentre l’iperprolinemia II è dovuta alla scarsa presenza della pirrolina-5-carbossilato deidrogenasi.
Esiste anche una condizione rara chiamata iperidrossiprolinemia, dove sono i valori di idrossiprolina a risultare elevati rispetto alla norma. Tuttavia questa condizione non sembra manifestarsi con conseguenze gravi.