Il principio di Le Chatelier o principio dell'equilibrio mobile
Il principio di Le Chatelier, così importante per comprendere la dinamica delle reazioni chimiche, si chiama anche principio dell’equilibrio mobile. Si tratta inoltre di un argomento che ricorre spesso nelle domande del TEST MED o del TEST VET (ex TOLC) tra i quiz di Chimica, oltre che nei test di ammissione alle Professioni Sanitarie.
Questo principio prende il nome da Henri Le Chatelier, un chimico francese vissuto nella seconda metà del 1800. Oltre alle sue scoperte relative all’equilibrio chimico è ricordato anche per aver inventato il pirometro ottico, che dal colore è in grado di stabilire la temperatura di un oggetto. Studiò inoltre la composizione delle leghe metalliche e il processo di sintesi dell’ammoniaca.
Cosa dice il principio di Le Chatelier
L’enunciato di questa regola afferma che un sistema in equilibrio tende a mantenersi tale, neutralizzando o minimizzando qualsiasi azione di disturbo che provenga dall’esterno. La definizione di sistema si può applicare anche ad una reazione chimica, il cui equilibrio può essere intaccato da più fattori.
Più precisamente se le concentrazioni dei reagenti aumentano allora l’equilibrio si muoverà verso la destra della freccia, dove ci sono i prodotti. Al contrario, se sono i prodotti a crescere questo si comporterà nel modo opposto spostandosi verso la sinistra della freccia. La direzione è determinata dallo squilibrio e gli si oppone per contenere la variazione.
La costante di equilibrio nel principio di Le Chatelier
Studiando il principio di Le Chatelier non si può trascurare il concetto della costante di equilibrio, che si indica con il simbolo Keq. Rappresenta la relazione che intercorre fra i reagenti e i prodotti di una reazione e la si calcola confrontando il prodotto delle concentrazioni di entrambi. Consideriamo per esempio una reazione generica aA + bB => cC + dD.
In questo esempio A e B sono i reagenti, C e D i prodotti e le lettere minuscole rappresentano i loro coefficienti stechiometrici. La costante di equilibrio di calcola secondo la formula [C]c[D]d/[A]a[B]b. Dunque Keq rappresenta il rapporto fra il prodotto delle concentrazioni dei prodotti e quello delle concentrazioni dei reagenti, dove ciascuna specie è elevata al proprio coefficiente stechiometrico.
Il valore di Keq è determinante secondo il principio di Le Chatelier per capire come si sposterà l’equilibrio della reazione. Se il suo valore è molto alto la concentrazione dei prodotti è maggiore e dunque ci sarà una variazione diretta verso la sinistra della freccia. Quando invece ha un valore basso significa che si è verificato un aumento dei reagenti e l’equilibrio si muoverà verso i prodotti.
La costante di equilibrio chimico non è influenzata solo dalle concentrazioni dei composti presenti, ma anche da variazioni ambientali.Tra queste possiamo nominare volume, pH, pressione e temperatura.
Il principio di Le Chatelier e la pressione
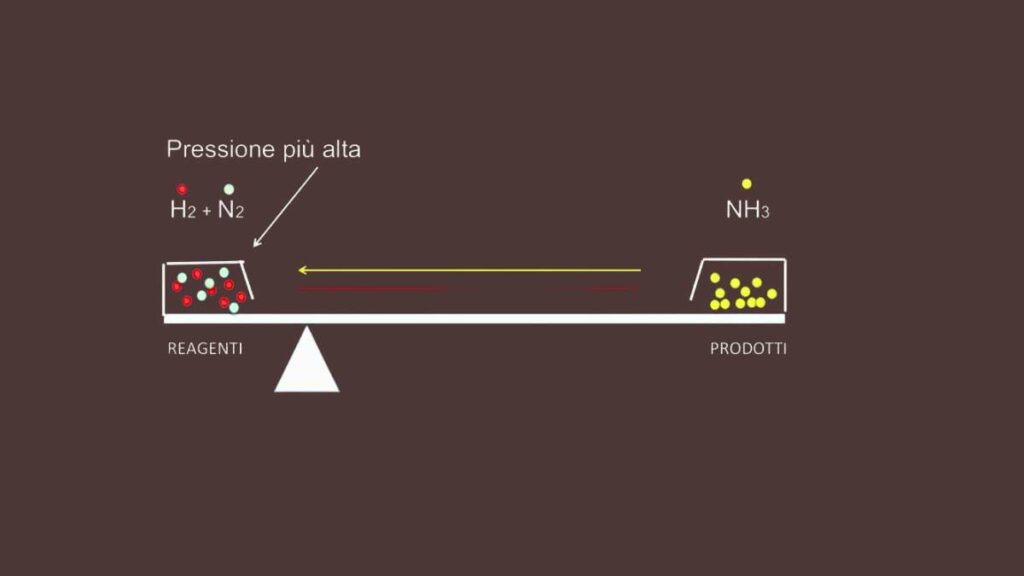
Nel caso dei gas invece se per esempio la pressione esercitata aumenta o diminuisce allora si riduce o si espande anche il volume delle moli delle sostanze. Ciò secondo il principio di Le Chatalier provoca una risposta che sposta l’equilibrio in base al numero di molecole presenti. Una pressione più alta lo muove verso il lato dove le particelle di gas sono minori, e le specie hanno pressione inferiore.
Nel caso inverso, ossia quello in cui la pressione diminuisca, l’equilibrio si muove al contrario verso il lato della freccia dove le molecole sono maggiori. In tal caso infatti le moli per unità di volume diminuiscono, dunque la variazione minore ce l’ha il lato dove i composti hanno una densità maggiore per volume.
Vediamo ad esempio la reazione N2(g) + 3H2(g) ↔ 2NH3(g). Se aumentiamo la pressione poiché le specie chimiche sono allo stato gassoso l’equilibro dovrà spostarsi verso la direzione dove ci sono meno molecole. Poiché osservando i coefficienti stechiometrici ci sono due moli di prodotto (2NH3) e quattro di reagenti (N2 + 3H2) si sposterà a destra della freccia.