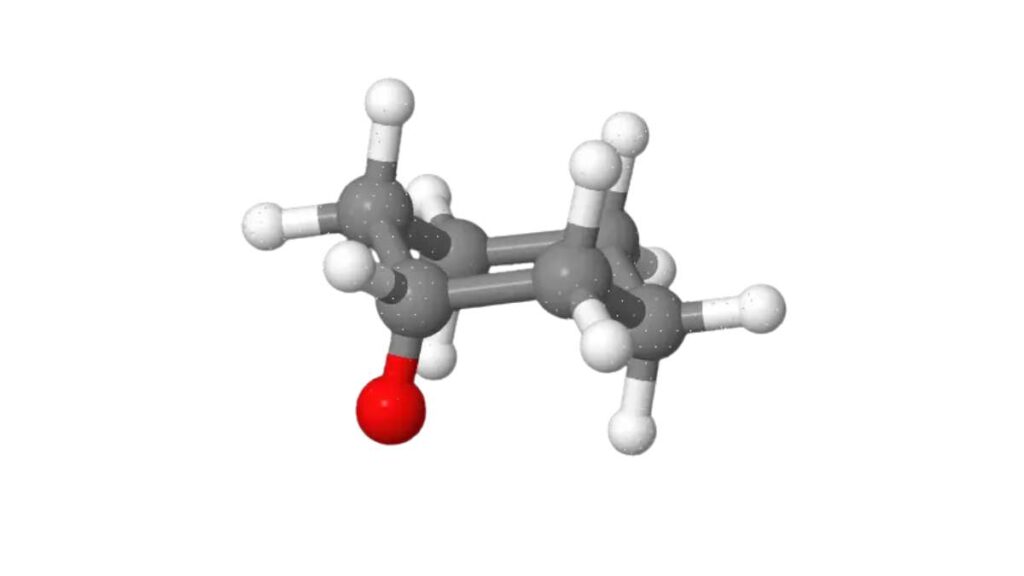
La molecola del cicloesano
La molecola del cicloesano appartiene al gruppo degli alcani ciclici, strutture ad anello che hanno formula generale CnH2n. Sono composti organi monociclici saturi, quindi non prevedono né la presenza di legami doppi né di legami tripli. Come gli alcani lineari contengono solo carbonio e idrogeno. Altri esempi sono il ciclopropano e il ciclobutano.
Solitamente rappresentiamo i cicloalcani in maniera semplificata ricorrendo ai poligoni regolari. Gli atomi di carbonio ne rappresentano i vertici e i legami fra due carboni sono i lati. In realtà però non si tratta davvero di strutture planari e l’anello risulta piegato, in quanto alcuni atomi si trovano su piani differenti.
La molecola del cicloesano e le proprietà dei cicloalcani
La formula bruta di questo composto organico è C6H12, stabile e che a temperatura ambiente si presenta come un liquido incolore. Presenta un odore pungente comune alla maggior parte degli idrocarburi ed è facilmente infiammabile. Il suo punto di fiamma, ovvero la temperatura minima a cui può prendere fuoco, è a -18°C.
Risulta nocivo per inalazione e contatto con la pelle, in quanto può provocare gravi irritazioni. I cicloalcani, gruppo di idrocarburi a cui appartiene il cicloesano, sono noti anche come cicloparaffine o nafteni. Sono inoltre composti aliciclici insieme alle classi dei cicloalcheni e dei cicloalchini, in quanto non presentano un anello aromatico.
Per sintetizzare i cicloalcani a livello industriale si sfruttano di solito gli alcheni da sottoporre a una reazione di addizione con il carbene. Si tratta di una specie chimica poco stabile con formula generica R2C. In alternativa si può ricorrere anche alla ciclizzazione di dialogenuri alchilici facendoli reagire con specie metalliche, specialmente con lo zinco.
La reattività dei cicloalcani è molto simile a quella degli alcani. Oltre a subire facilmente combustione possono reagire con l’idrogeno molecolare (H2) e aprire l’anello, riformando un alcano con catena lineare. Se fatti reagire con degli acidi alogenidrici, ovvero HX (con X appartenente al gruppo di alogeno) invece formano alcani alogenati.
La conformazione a sedia della molecola
Dopo questa introduzione alle proprietà chimiche e fisiche del composto possiamo dedicarci alla struttura molecolare del cicloesano. Partiamo da quello che è il conformero più stabile, ovvero quello a sedia. Troviamo gli idrogeni legati ai carboni dell’anello in due posizioni e li definiamo in base a questa assiali o equatoriali.
I legami fra carbonio e idrogeno assiale si presentano tutti paralleli fra di loro, oltre che all’asse di simmetria della molecola. Invece gli idrogeni equatoriali giacciono tutti sul piano generale del composto organico. Per disegnare questa conformazione, che mette sempre in difficoltà gli studenti, si parte con due linee parallele di cui una leggermente spostata verso destra.
A questo punto si congiungono le estremità verso destra formando una V, e lo stesso dalla parte opposta ma con le linee rivolte verso l’alto. Gli angoli di legame fra due carboni consecutivi della conformazione a sedia del cicloesano sono di 111°. Grazie a questo risulta un conformero quasi privo di tensione angolare.
Sempre in questa conformazione le forze di Van der Waals risultano ridotte al minimo. Si tratta di interazioni di natura elettromagnetica che si formano tra atomi vicini, in quanto funzionano solo a corto raggio. Un discorso molto diverso vale invece per il conformero che esamineremo al paragrafo successivo.
La conformazione a barca del cicloesano
Il secondo conformero da esaminare è molto meno favorito energicamente rispetto a quello descritto al paragrafo precedente in quanto meno stabile. La si definisce conformazione a barca in quanto la sua rappresentazione ricorda uno scafo stilizzato. I due conformeri possono coesistere in equilibrio in determinate condizioni, passando da uno all’altro.
A livello energetico il passaggio dispiega molto poco, circa 11 kcal/mole. Questo permette al passaggio di avvenire anche a temperatura ambiente, senza bisogno di fornire ulteriore energia. La conformazione a barca del cicloesano, diversamente da quella a sedia, mantiene una certa flessibilità a livello di struttura molecolare. Questo le permette di creare delle forme dette twisted oppure a treccia.
Per passare dalla molecola con conformazione a sedia a quella a barca è sufficiente flettere un’estremità della prima. In genere si portano verso l’alto i carboni nelle posizioni 1 e 4, che in questa forma hanno una distanza molto breve fra loro. Questo porta alla formazione di una torsione sterica fra i due atomi.
Abbiamo anche la conformazione detta a semisedia, una forma twisted dove abbiamo cinque dei sei atomi di carbonio che giacciono sullo stesso piano. Si tratta di una forma che la molecola assume temporaneamente nel passaggio dalla conformazione a sedia a quella a barca. A temperatura ambiente inoltre non è possibile separare queste due conformazioni.