Miscele racemiche: cosa sono e perché sono importanti in chimica organica
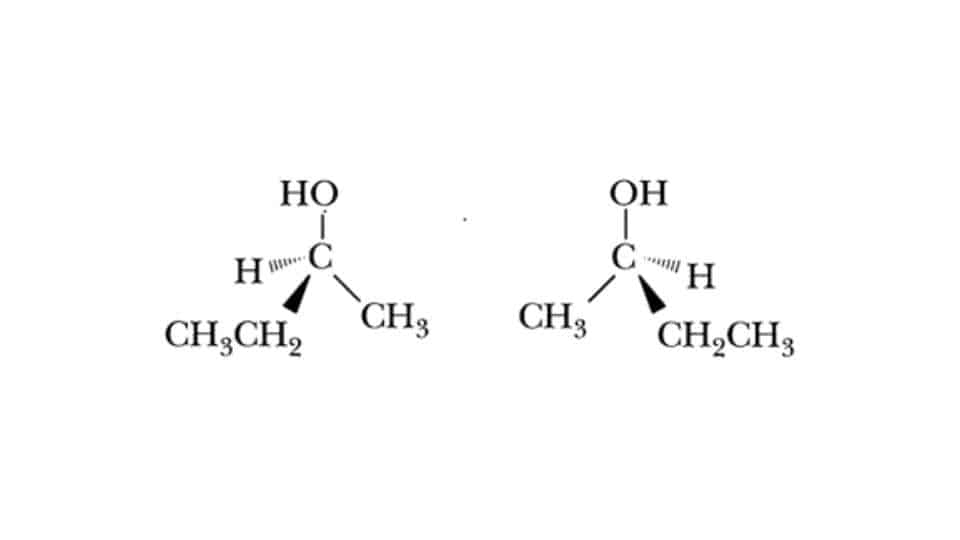
Quando si parla di miscele racemiche bisogna prima richiamare per cenni cosa sono gli enantiomeri in Chimica Organica. Sono citati anche come isomeri ottici, e si tratta di molecole chirali che sono immagini speculari l’una dell’altra, perciò simili ma non sovrapponibili. Non ci sono piani di simmetria in queste molecole organiche e nemmeno centri di inversioni.
Per descriverli si fa sempre ricorso all’esempio della mano destra e della mano sinistra. Tra di loro queste coppie di molecole hanno però proprietà simili, tra cui la stessa temperatura di ebollizione e lo stesso punto di fusione. Dato che hanno anche una solubilità identica in soluzione separarli quando sono miscelati risulta molto complesso. Esistono però delle tecniche che lo consentono.
Come si ottengono le miscele racemiche
Prima di studiare come separare gli enantiomeri presenti in questo tipo di miscele bisogna capire come vengono a formarsi. I processi noti che ne producono una sono tre, tra cui una è banalmente unire due isomeri ottici mescolandoli con un rapporto 50:50, detto equimolare. Avendo la stessa solubilità questo non risulta difficile, e gli enantiomeri mescolati si definiscono racemi.
Il secondo processo chimico da cui è possibile ricavare delle miscele racemiche è quando si sfruttano reagenti achirali per ricavare un composto chirale. I composti achirali sono molecole dove non è presente un centro di chiralità, ovvero un carbionio che leghi quattro sostituenti diversi e non presenti perciò alcun asse di simmetria. Ne basta uno per definire una molecola chirale.
Il terzo e ultimo sistema per ricavare queste miscele organiche si chiama racemizzazione. Prevede una reazione che trasforma un singolo enantiomero in una coppia dl, un modo diverso per definire una miscela di due isomeri ottici. Per farlo occorre sfruttare un composto otticamente attivo e trattarlo con un reattivo in grado di trasformarlo nella molecola speculare.
Uno dei reattivi che si utilizza questo scopo è lo ione ioduro (I-) se utilizzato con alcani che legano lo iodio come alogeno. La reazione è reversibile, in modo tale che all’equilibrio sono presenti entrambi gli isomeri del composto di partenza. La racemizzazione è un processo possibile anche con gli amminoacidi, che presentano quasi tutti chiralità.
Come separare gli enantiomeri miscelati
Come accennato fare la risoluzione delle miscele racemiche, un altro modo per indicare la separazione dei due isomeri, non è facile. Il primo scienziato che vi riuscì fu il chimico e microbiologo Louis Pasteur nel 1849, mentre studiava l’attività ottica dell’acido tartarico. Per farlo ricorse alla cristallizzazione, e osservò proprio nella forma cristallina che questo formava due enantiomeri, osservandoli al microscopio
Si tratta di una separazione che si può indurre all’interno di una soluzione satura sfruttando cristalli puri di entrambi gli isomeri ottici. Se la cristallizzazione è il metodo più antico però non è certo l’unico. Un’altra via possibile è far reagire la miscela con un composto otticamente attivo che generi due diastereoisomeri. A differenza degli enantiomeri questi infatti avranno fra loro proprietà fisiche differenti.
Sfruttare queste differenze, come diverse temperature di fusione o ebollizione, rende più semplice separare le miscele racemiche di partenza. Più spesso però si sfrutta una differenza di solubilità, facendo cristallizzare uno dei due enantiomeri. In alcuni casi si può anche ricorrere alla cromatografia, una tecnica di laboratorio usata anche per la purificazione.
Infine per la risoluzione delle miscele si può anche fare ricorso all’impiego di enzimi, Essendo altamente specifici per il proprio substrato e quindi legano uno solo dei due enantiomeri. Questo consente di lasciare una delle due molecole libera mentre l’altra sarà del tutto “sequestrata” dal sito attivo dell’enzima. In questo modo risulteranno fisicamente separati.
Le miscele racemiche in ambito farmaceutico
Un esempio è la tiroxina, che corrisponde all’ormone tiroideo che regola il metabolismo del nostro organismo oltre che la sua crescita. Si produce anche per via sintetica e si somministra ai pazienti che soffronodi disturbi alla tiroide. Ora si produce solo nella forma della levotiroxina, l’unica che siamo in grado di assimilare, e si produce sia nel formato di gocce che capsule da assumere per via orale.
Esempi di miscele racemiche commercializzate negli anni ’80-’90 invece sono il ketoprofene e la fluotexina. Il primo è un medicinale antinfiammatorio non steroideo che si può assumere sia per orale che rettale, usato per trattare diversi disturbi dal mal di testa all’artrite reumatoide. Invece la fluotexina trova applicazione come antidepressivo e per attenuare i sintomi dell’ansia.
In molti casi produrre l’entantiomero singolo rappresenta un miglioramento del farmaco che prima esisteva solo nella forma di miscela. Per prima cosa il medicinale ha un’efficienza maggiore, e anche gli effetti collaterali che può portare risultano meno pesanti. Anche la velocità di assorbimento del farmaco risulta spesso migliorata.
La racemizzazione degli amminoacidi
Il processo con cui si forma l’enantiomero speculare degli amminoacidi è graduale, e si ferma quando si arriva a un equilibrio fra le forme L e D. Questo stadio si definisce racemo, ma non si raggiunge nello stesso tempo per tutti gli amminoacidi. Anche la temperatura a cui rimangono i resti degli organismi ha un certo peso, ma rimane una tecnica di datazione efficace nel caso delle ossa.