L'importanza biologica degli eterocicli
In Chimica quando parliamo di eterocicli ci riferiamo a delle particolari strutture presenti dei composti organici. Diversamente dagli anelli semplici di atomi di carbonio questi prevedono la presenza anche di atomi di altri elementi. Questi si definiscono eteroatomi e i più comuni sono zolfo (S), ossigeno (O). azoto (N) e fosforo (P). Meno di frequente è possibile trovare anche il selenio (Se).
L’ampiezza di questi anelli può variare dai tre (triatomici) ai sei (esatomici), che però indica il numero complessivo di atomi presenti. Si può effettuare un’ulteriore classificazione basandosi invece sul numero di eteroatomi presenti al suo interno. Li possiamo trovare in molecole organiche di fondamentale importanza nel nostro organismo, come ad esempio nelle basi azotate.
Gli eterocicli di natura non aromatica: esempi
La nomenclatura degli eterocicli di questo tipo prevede il prefisso ciclo di fronte al nome del composto (butano, propano, esano ecc.). A sua volta questo è preceduto da un prefisso che indica l’eteroatomo presente, per esempio azo- per l’azoto, osso- per l’ossigeno e tio- per lo zolfo. Per numerare i sostituenti legati all’anello si assegna la posizione 1 proprio all’eteroatomo.
un esempio di composto eterociclico non aromatico è la piperidina, che ha formula bruta (CH2)5NH. A temperatura ambiente questa sostanza è allo stato liquido e ha un odore pungente che ricorda quello del pepe. Trova impiego nelle industrie chimiche sia come solvente per degradare dei composti che come base. Come farmaco ha proprietà analgesiche.
Sempre a questa categoria di composti organici appartiene anche la pirrolidina, un’ammina secondaria di formula C4H9N. Si presenta come un liquido incolore ma che tende ad ingiallire rapidamente all’aria e dall’odore forte e sgradevole. Trova diverse applicazioni in campo farmaceutico grazie alle sue proprietà antinfiammatorie.
Gli anelli aromatici con etereoatomi
Oltre ai composti visti al paragrafo precedente possiamo avere delle strutture ad anello dove sia gli atomi di carbonio che gli eteroatomi hanno ibridazione sp2. Come nel caso del benzene quindi abbiamo una molecola planare, mentre a livello della distribuzione elettronica il doppietto dell’elemento diverso può delocalizzarsi nell’anello.
Più risulta alto il valore di elettonegatività dell’eteroatomo maggiore è l’aromaticità del composto in esame. Esaminando le molecole organiche che contengono queste strutture possiamo vedere che troviamo solo anelli formati da cinque o sei atomi. Per gli anelli eterociclici non aromatici invece era possibile averne anche solo di tre o quattro atomi.
Passiamo a un esempio noto, ossia il furano, che fa parte degli eterocicli aromatici che contengono l’ossigeno. In forma pura risulta come liquido volatile e facilmente infiammabile. Si forma di solito durante la combustione di alcune varietà di legno (es. pino) e in alcuni processi produttivi alimentari. Risulta classificato come potenziale cancerogeno e se ne analizza la presenza nei cibi dal 2004.
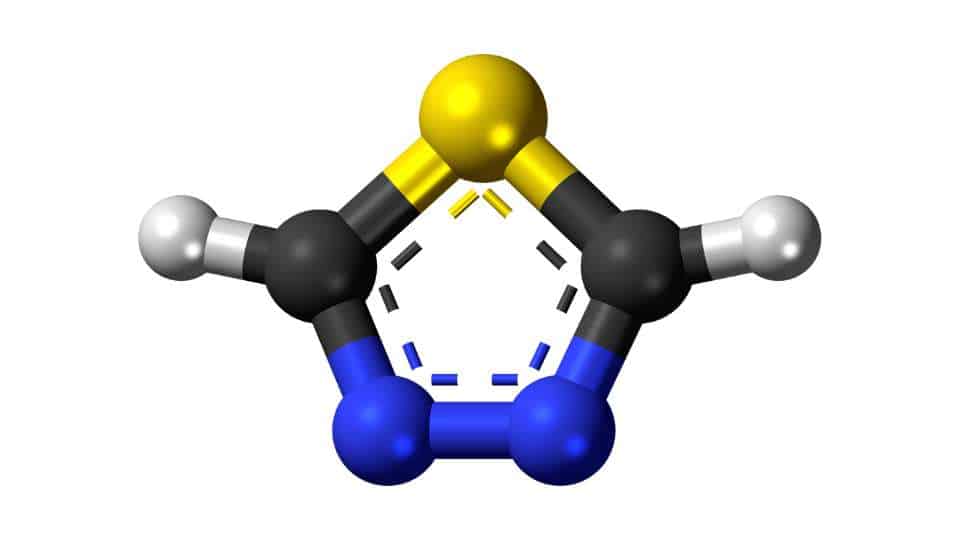
Possiamo citare anche il tiofene, che ha sempre un anello a cinque atomi ma contiene zolfo (formula C4H4S). Anche questo a temperatura ambiente è liquido e ossida rapidamente all’aria assumendo una colorazione giallastra. Risulta però utile sia per la sintesi di farmaci che per prodotti fitosanitari, oltre che per effettuare la denaturazione dell’etanolo.
La presenza degli eterocicli in natura
Tra le antocianine c’è per esempio la petunidina, una sostanza vegetale che conferisce una colorazione variabile dal rosso intenso alla malva. Si trova sia nei petali dei fiori della petunia, da cui deriva il nome, che all’interno di alcuni tipi di bacche. Non è tossica e si può utilizzare anche come colorante alimentare, sotto la sigla E163 o E165f.
Altri composti naturali ben conosciuti dove possiamo evidenziare la presenza di eterocicli sono le porfirine. La loro struttura appare come una struttura chiusa composto a sua volta da quattro anelli pirrolici uniti da gruppi metile. La porfirina forma facilmente dei chelati con ioni metallici che si legano al centro della struttura. Tra i più comuni ci sono il ferro (Fe), il magnesio (Mg) e il rame (Cu).
Le porfirine si trovano sia all’interno dell’emoglobina che della clorofilla. La prima è la proteina globulare che trasporta l’ossigeno nel nostro organismo accumulandosi all’interno dei globuli rossi. Come sappiamo la clorofilla invece permette il processo della fotosintesi clorofilliana e quindi la produzione di glucosio e ossigeno da parte delle piante.