Equazione di Arrhenius e l'energia di attivazione
La definizione dell’equazione di Arrhenius risale a più di un secolo fa, per la precisione al 1889. Deve il suo nome al fisico e chimico svedese Svante Arrhenius, vincitore del premio Nobel per la Chimica nel 1903 per le sue scoperte sul trasferimento degli ioni. La finalità della sua equazione però stabilisce la relazione che intercorre fra la velocità delle reazioni chimiche e la temperatura a cui si svolgono.
A livello generale possiamo dire che più è caldo l’ambiente più veloci sono le reazioni, ma i meccanismi che comportano queste variazioni sono in realtà molto complessi. Esistono infatti due formule per tradurre le scoperte del chimico svedese, una che si applica alle mole dei reagenti e l’altra a livello molecolare. L’aspetto che cambia è la costante interna alla formula (R o KB).
Introduzione all’equazione di Arrhenius
Prima di esaminare la formula dobbiamo introdurre alcuni concetti che possono rendere più semplice la sua interpretazione. Partiamo dalla velocità di una reazione chimica, che per definizione è la variazione delle concentrazioni dei reagenti e nei prodotti in un determinato intervallo di tempo. Si tratta di una grandezza intensiva e dunque non dipende dalle loro masse.
Di base ciò che influenza di più questa velocità è la concentrazione dei reagenti, anche se poi con l’equazione di Arrhenius ci concentreremo di più sulla temperatura. A questo proposito però dobbiamo anche introdurre il concetto di ordine di reazione, poiché in Chimica ci sono dei processi detti di ordine zero che non risentono della concentrazione dei reagenti. Un esempio sono le reazioni fotochimiche.
Tra i fattori che intervengono sulla velocità di reazione oltre ai due appena elencati possiamo nominare la superficie di contatto fra i reagenti, che più è ampia più velocizza i processi chimici. Infine dobbiamo menzionare l’eventuale presenza di catalizzatori, come per esempio vale per gli enzimi che intervengono nel nostro metabolismo.
Per comprendere gli studi di Svante Arrhenius è necessario menzionare anche la teoria degli urti. Proposta da Trautz e Lewis nel 1916 spiega a livello quantitativo lo svolgimento delle reazioni chimiche. Queste infatti dipendono dalle collisioni che si verificano fra le molecole dei reagenti, o meglio dalla loro intensità e dall’orientamento con cui avvengono.
Lo studio della formula
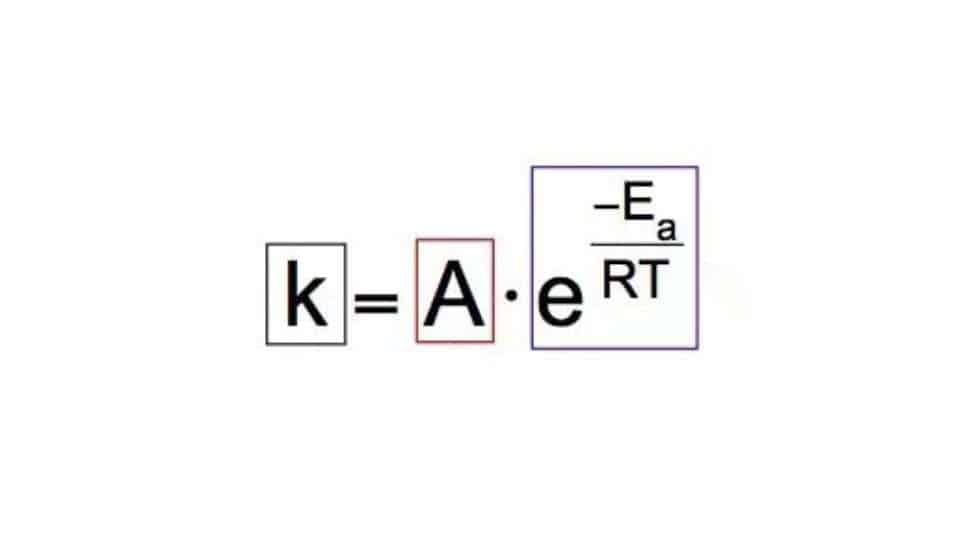
Passiamo a esaminare l’equazione di Arrhenius partendo dalla sua formulazione più usata. Vale a dire che la costante cinetica di un processo chimico si calcola usando la formula k = Ae-Ea/RT. In particolare:
- A è il simbolo del fattore di frequenza e dipende essenzialmente dalla natura delle sostanze reagenti. Riguarda la frequenza con cui avvengono le collisioni fra le molecole e a come si orientano fra di loro.
- Ea rappresenta l’energia di attivazione della reazione chimica e si misura in Joule o kilojoule per mole (J/mol o kJ/mol).
- R è la costante universale dei gas perfetti, e in questo caso il valore che ha è (8,314 J/mol/K).
- T è la temperatura assoluta a cui avviene la reazione chimica.
- e rappresenta il numero di Nepero usato nel logaritmo naturale (ln).
Nell’equazione di Arrhenius inoltre l’espressione e-Ea/RT se considerata come un unico fattore inoltre rappresenta la frazione di collisioni fra molecole con energia sufficiente per attivare la reazione (energia minima). Osservando la formula ricaviamo che la velocità di reazione è inversamente proporzionale rispetto all’energia di attivazione di un processo chimico.
Sempre dalla formula però si evince una relazione di proporzionalità diretta fra k e T, ossia la temperatura del sistema in cui si svolge il processo chimico. Per questo motivo nei processi industriali delle aziende chimiche si fa particolare attenzione alla temperatura in modo da migliorare la resa di produzione.
Dall’equazione di Arrhenius al grafico
La retta che si costruisce su questo grafico a partire dall’equazione di Arrhenius ha come coefficiente angolare (m) il fattore – Ea/R. Una volta disegnata si può osservare come sia inclinata verso il basso, avvicinandosi al valore 0 dell’ascissa man mano che il valore di lnk scende. Il punto di intersezione fra la retta e l’asse y (lnk) individua il valore del fattore di frequenza A.
L’utilizzo di R, che come unità di misura ha J/mol, va bene solo finché si considerano i reagenti espressi in moli. Volendo applicare l’equazione e il grafico a livello molecolare bisogna sostituire a R la costante di Bolzmann (KB). Rappresenta la costante di proporzionalità tra la temperatura e l’energia cinetica posseduta dalle particelle di un gas ideale.
Il valore della costante di Bolzmann secondo il Sistema Internazionale delle unità di misura è 1,3806 x 10-23 J/K. La relazione che KB ha con la costante R è espressa dalla formula KB = R/NA, dove NA rappresenta il numero di Avogadro (il numero di particelle contenute in una mole di sostanza).