La struttura dei composti ionici
Le molecole che derivano da un legame fra ioni si definiscono composti ionici. Si parla di legame ionico quando fra gli elementi coinvolti esiste una marcata differenza in termini di valore di elettronegatività. Per la precisione quando la differenza fra i due valori è maggiore o uguale a 1,9. Pur contenendo ioni però la carica di queste molecole è neutra, ossia nulla.
Un esempio classico di questo tipo di composti sono le molecole che derivano dal legame di un alogeno con un metallo del primo o del secondo gruppo. I metalli alcalini e alcalino-terrosi hanno carica positiva, mentre gli alogeni hanno carica negativa. Solo gli ioni di segno opposto si attraggono, mentre se la carica è concorde si respingono.
Cationi e anioni nei composti ionici
Come precisato una molecola formata da due ioni se va incontro a scissione ridarà come prodotti uno ione di carica negativa e uno positiva. Il primo si definisce anione, il secondo invece si chiama catione.
Non è difficile distinguerli dato che il primo accanto al simbolo dell’elemento chimico porta il segno “-” e il secondo il segno “+”.
Un esempio classico riportato sui libri quando si parla dei composti ionici è quello del cloruro di sodio (NaCl).
Si forma infatti dall’unione dello ione sodio (Na+) e dallo ione cloro (Cl-). Possiamo avere anche ioni poliatomici, formati quindi da più di un atomo, come vale per l’acido fosforico (H3PO4). Se si dissocia completamente forma 3 ioni idrogen (H+) e uno ione fosfato (PO43-).
Nella formazione del legame ionico non abbiamo una semplice condivisione di elettroni come avviene con quello covalente. In genere l’elemento meno elettronegativo perde uno o più elettroni acquistando carica positiva, mentre l’altro si trasforma in uno ione negativo. Si sviluppa così un’attrazione elettrostatica fra i due ioni.
In ogni composto dove ci sono due ioni la formula molecolare indica anche la proporzione esistente fra cationi e anioni. I solidi ionici si presentano infatti come reticoli cristallini invece che come singole molecole. Si forma come precisato fra non metalli e metalli, che sono ai poli opposti della tavola periodica.
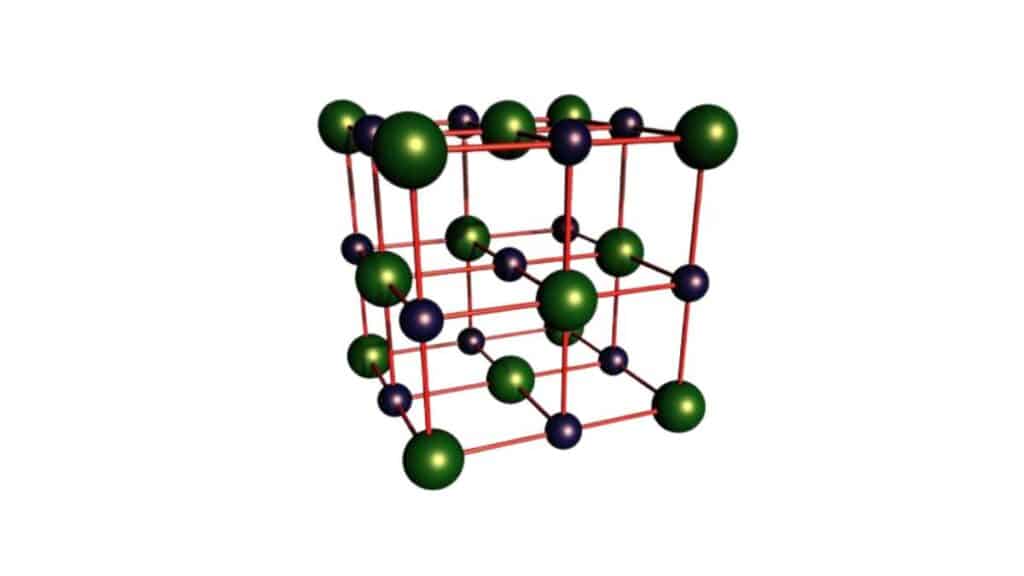
La struttura di un cristallo formato da ioni
Quando parliamo di solidi ionici ci riferiamo a strutture organizzate sotto forma di reticolo cristallino dove sono presenti ioni di carica opposta.
Il numero di ioni vicini fra loro nei composti ionici dipende dalle dimensioni relative fra i due elementi o sostanze. In sintesi, alla loro differenza in termini di raggio atomico.
Classifichiamo queste strutture come solidi cristallini con legami non direzionali. Infatti il campo elettrico che risulta dall’interazione delle specie cariche si irradia in tutte le direzioni.
In questo reticolo non è possibile individuare delle singole molecole ma tutt’al più delle celle elementari, che sono le unità replicate all’interno del cristallo.
Ogni cella elementare è rappresentativa del rapporto tra gli ioni che compongono i composti ionici. Perché si formi la struttura a reticolo e rimanga stabile la condizione necessaria è che la forza attrattiva fra cariche opposte superi quella repulsiva. In formula scriviamo allora Fa > Fr , che rappresenta il requisito di stabilità.
Perché sia soddisfatto dal punto di vista spaziale la distanza fra gli ioni di segno opposto deve essere inferiore a quella fra cariche concordi. Un cristallo si forma in genere con il punto di coordinazione più alto possibile, ossia con il maggior numero di ioni interagenti con lo ione singolo.
Composti ionici e la costante di Madelung
L‘energia reticolare è quella che si libera quando si formano i reticoli cristallini dei composti ionici a partire dagli ioni allo stato isolato. Calcolarla consente di determinare la stabilità del reticolo, che è direttamente proporzionale rispetto a questa grandezza. La formula che si usa per trovarla è Er= – MNz2/4πε0d, dove rispettivamente:
- M è la costante di Madelung, un valore che risulta sempre superiore a 1.
- N è il numero degli ioni positivi presenti all’interno del reticolo.
- d rappresenta la distanza fisica che c’è tra gli ioni e si misura in metri.
- z è la carica degli ioni e si calcola in Coulomb (C).
- ε0 infine rappresenta una costante che ha valore di 8,85 x 10-12 C2/mJ.
Solidi formati da ioni e solidi covalenti a confronto
Un esempio di solido covalente è il diamante, il materiale più duro esistente in natura formato da carbonio purissimo. Pur essendo un isolante elettrico ha un’ottima conducibilità termica, e prende fuoco a circa 850 °C.