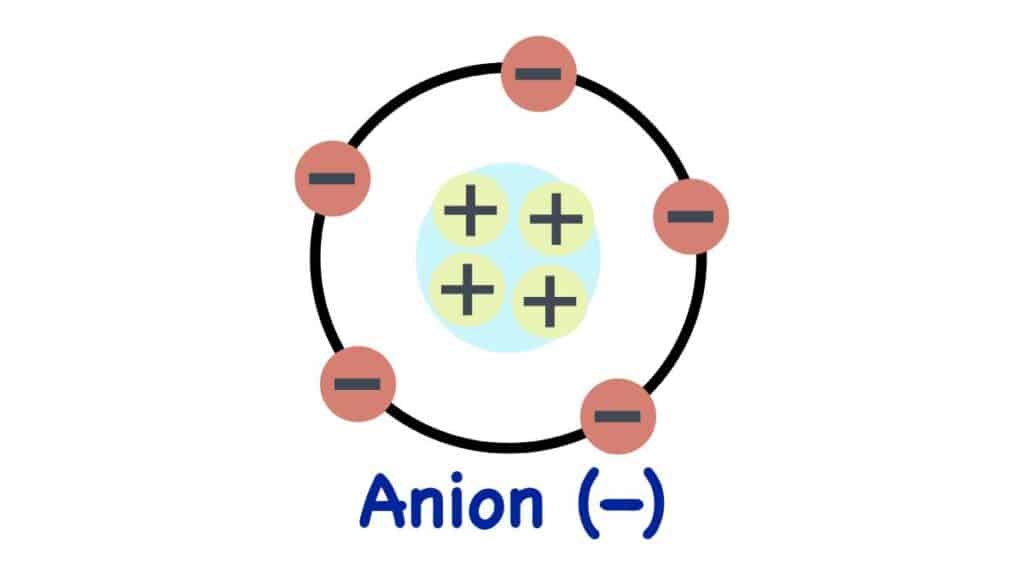
Anioni: ioni dotati di carica negativa
Parlare di anioni e cationi significa riferirsi ad atomi o molecole dotate di carica, non neutri come siamo abituati a ritenerli. Se un elemento perde o acquisisce un elettrone infatti diventa elettricamente carico: tale carica può essere positiva o negativa. Fra di loro queste si attraggono se di segno opposto e si respingono se invece questo è concorde.
Di seguito ci concentreremo su atomi e complessi molecolari dotati di carica negativa (-), e che hanno perciò acquistato degli elettroni. La denominazione di anioni deriva dal fatto che se sottoposti a un campo elettromagnetico migrano verso l’anodo (che ha carica positiva). Viceversa i cationi si spostano in direzione del catodo.
Come si indica un anione e che reazioni lo producono
Solitamente quando scriviamo la formula di una sostanza chimica i limitiamo a mettere il numero di atomi che prevede.
La simbologia la troviamo nella Tavola Periodica: il cloruro di sodio è NaCl, l’idrogeno molecolare è H2, il solfato rameico è CuSO4 e così via. Ci sono però dei casi in cui accanto alla molecola occorre riportare dei valori in più, ossia quando è uno ione.
Sia cationi che anioni contengono infatti il termine “ione”, ma aggiungono il dettaglio del segno della carica portata dall’elemento o dalla molecola. Questa si indica in alto a destra della formula molecolare, come un esponente, a cui apporre di fianco il segno, che nel caso di un anione sarà “-“. Per esempio lo ione cloruro, che ha carica -1, si scriverà Cl−.
Se le cariche negative sono più di una, come nel caso dello ione solfato, indichiamo SO42-. Ma quando si ottengono degli ioni con carica negativa? Questo ultimo esempio ci dà un indizio, dato che troviamo lo ione solfato legato all’idrogeno per formare l’acido solforico, che ha formula H2SO4. La dissociazione degli acidi in acqua infatti porta a rilasciare gli idrogeni acidi H+, e a formare ioni negativi.
Per capire quante cariche negative acquisirà la parte di molecola che resterà perdendo gli idrogeni basta guardare il loro numero. Se togliessimo tutti gli H+ dall’acido fosforico (H3PO4) ci rimarrebbe solo lo ione fosfato, ossia PO43-. Nel caso dell’acido iodidrico (HI), che ha solo un idrogeno, lo ione fosfuro avrà solo una carica (I-).
La nomenclatura degli ioni negativi
Anche nel caso delle molecole dotate di carica ci sono delle regole perché si possa dare loro una denominazione. La prima cosa da evidenziare quando si è di fronte a un anione è distinguere da quali composti derivano. Se si formano in seguito alla dissociazione di un idracido per esempio si parla di anioni monoatomici. Gli idracidi sono formati da idrogeno + alogeno.
Possiamo citare come esempi l’acido cloridrico (HCl) e l’acido solfidrico (H2S). Gli ioni negativi però si possono formare anche a partire dagli ossiacidi, composti ternari formati da idrogeno + non metallo + ossigeno. In tal caso li si definisce ossoanioni. Sia gli anioni monoatomici che gli ossoanioni possono derivare da una dissociazione completa o incompleta.
Nel primo caso non avranno idrogeni nella loro formula, come il ClO3–. Quando invece si ha una dissociazione completa nella formula dell’anione ci sarà almeno un atomo di idrogeno, come ad esempio per lo ione HSO4–. I nomi degli anioni derivati dagli ossiacidi hanno desinenza -ito se derivano da un acido che termina in -oso, e -ato se da uno che termina in -ico.
Quindi se prendiamo l’acido perclorico (HClO4) e lo facciamo dissociare otterremo lo ione perclorato (ClO4–). Invece dall’acido solforoso (H2SO3) possiamo ricavare per dissociazione completa lo ione solfito (SO32-). Per tutti gli anioni monoatomici invece usiamo la desinenza -uro, premettendo che si tratta di ioni per non confonderli con i sali binari.
Anione da dissociazione incompleta
Per dare un nome dei complessi parzialmente dissociati serve un piccolo approfondimento, e si ricorre di solito alla nomenclatura IUPAC. Oltre alle desinenze già viste occorre mettere come prefisso il numero di idrogeni.
Prendiamo il caso dell’acido solforico (H2SO4), che avendo due idrogeni va incontro a due dissociazioni. Nella prima abbiamo H2SO4 => H+ + HSO4–. L’anione che otteniamo qui sarà lo ione monoidrogeno tetraossosolfato, dato che c’è un solo idrogeno nella sua formula. Ora prendiamo l’acido fosforico (H3PO4), che avendo tre idrogeni può formare due diversi ossoanioni da dissociazione incompleta.
Durante la prima dissociazione otteniamo H3PO4 => H+ + H2PO4–, dove perde il primo idrogeno acido. Ne ricaviamo lo ione diidrogeno tetraossofosfato. Dalla seconda avremo invece H2PO4– => H+ + HPO42-, che sarà lo ione monoidrogeno tetraossofosfato. Solo una volta terminati gli idrogeni useremo la regola vista in precedenza.
Volendo usare la nomenclatura tradizionale invece scriveremo solo ione + nome in ito/ato + acido. La dicitura acido indica la presenza di un idrogeno, e se sono più di uno è sufficiente indicare se biacido, triacido ecc. Quindi HCO3– è lo ione carbonato acido, invece H2PO4– che ha due idrogeni è lo ione fosfato biacido.