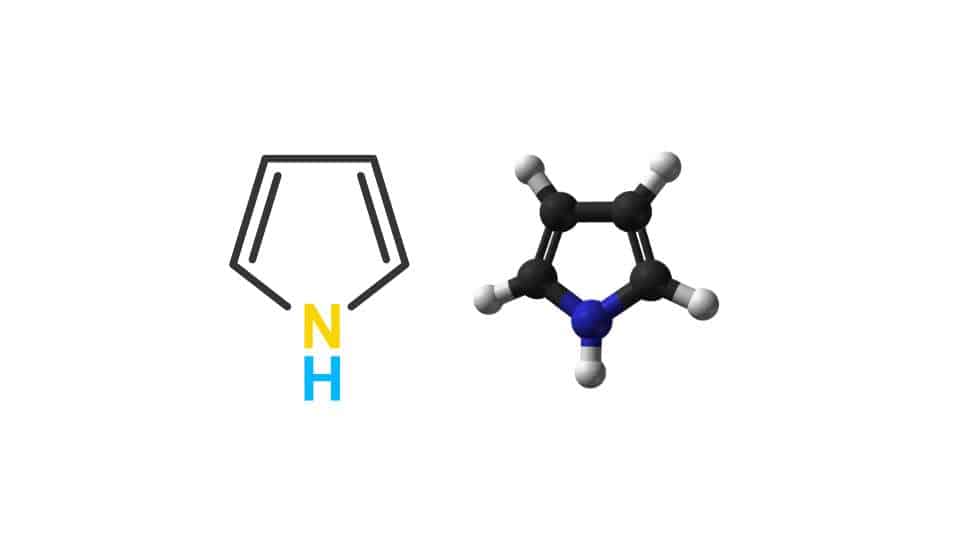
La struttura del pirrolo in chimica organica
In Chimica Organica definiamo il pirrolo come il più semplice fra gli azoli. Si tratta di composti di natura aromatica che presentano un anello eterociclico, dove l’eteroatomo è l’azoto (N). Un primo metodo di sintesi per realizzarlo si scoprì nel 1860 sfruttando la pirolisi del sale di ammonio prodotto dall’acido mucico.
Questo composto esiste anche in natura, sia negli organismi animali che vegetali. Si trova infatti all’interno di composti organici di struttura complessa come ad esempio le porfirine, come l’emoglobina o la clorofilla. Inoltre i suoi derivati trovano un’ampia applicazione sia all’interno del campo farmaceutico che nel settore agricolo per le loro proprietà chimico-biologiche.
Struttura del pirrolo e degli azoli
La formula bruta di questo composto organico è C4H5N. Si presenta dal punto di vista strutturale come un anello aromatico composto da cinque atomi. Quattro sono di carbonio (C) e uno di azoto (N), che rappresenta l’eteroatomo. L’azoto ha un’ibridazione sp2 e presenta una parziale carica positiva. Anche se lo si annovera negli azoli questi composti sono più complessi perché prevedono più eteroatomi,
Possiamo definire gli azoli come composti eterociclici a cinque atomi che contengono azoto, che possono essere aromatici o meno. Oltre al pirrolo i più noti sono il pirazolo (C3H4N2) e l’imidazolo, che ha la stessa formula del pirazolo ma presenta il secondo azoto in posizione diversa. Ci sono anche azoli con ben tre atomi di azoto, come l’1,2,3-triazolo e l’1,2,4-triazolo.
Questi composti organici si sfruttano principalmente per le loro proprietà antifungine. Li troviamo in molti farmaci prescritti per questo tipo di infezioni (micosi), e in più sono spendibili come antibatterici e antiparassitari. L’imidazolo si usa anche per preparare prodotti fungicidi per contrastare la formazione di questi organismi sulle colture.
Tra gli azoli troviamo anche dei composti che oltre all’azoto presentano nel proprio anello anche uno o più atomi di ossigeno (O o di zolfo (Z). Come esempi possiamo citare per il primo caso l’ossazolo (C3H3NO) e per il secondo invece il tiazolo (C3H3NS). Quest’ultimo composto è noto per il suo utilizzo come pesticida in agricoltura.
Le proprietà fisiche e chimiche della molecola
Iniziamo a esaminare il pirrolo in modo più accurato, senza limitarci alla formula. A temperatura ambiente si presenta come un liquido oleoso privo di colore se risulta puro, ma che se esposto all’aria si ossida rapidamente e assume una colorazione giallastra o bruna. Ha una bassa solubilità in acqua, ma si scioglie facilmente in solventi come l’etere e l’alcol etilico.
Questo composto presenta una basicità molto debole, ma può comportarsi anche come acido debole in determinate condizioni. La sua costante di dissociazione basica è pari a 2.5 · 10-14 e non è una molecola molto reattiva. Tuttavia è possibile sottoporlo a un’idrogenazione parziale e far perdere all’anello il carattere aromatico. Per farlo occorre svolgere la reazione in presenza di acidi e di metalli.
Sfruttando il platino in ambiente acido è possibile riuscire a ridurre il pirrolo fino a ottenere la pirrolidina, che ha un anello eterociclico privo di doppi legami. La pirrolidina è una molecola che si usa come solvente in diverse reazioni dei composti organici e che ha un carattere basico molto più forte dell’azolo da cui deriva.
Il composto che stiamo studiando può anche reagire dando luogo a una sostituzione elettrofila. Sfruttando acido nitrico (HNO3) e anidride acetica (C4H6O3) si può eseguire la nitrazione, mentre con anidride solforica (SO3) e piridina si può fare la solfonazione. Può anche subire l’alogenazione o l’alchilazione.
Come avviene la sintesi del pirrolo
Dopo aver speso qualche parola sulle reazioni del composto è ora di capire come è possibile produrlo. Il metodo più noto si chiama Sintesi di Paal – Knorr, usata anche per sintetizzare il furano e il tiofene. In effetti la si studiò inizialmente per ricavare il furano, ma con piccoli aggiustamenti è possibile ricavare anche le altre due molecole.
Per tutti e tre i processi le molecole di partenza sono gli 1,4-dichetoni, ottenuti a fine ‘800 dai due chimici che danno il nome al metodo di sintesi. Nel caso del pirrolo si comincia con uno di questi composti che a livello di uno dei due gruppi carbonilici subisce l’attacco di un’ammina e forma un composto intermedio chiamato emiamminale. Il gruppo amminico attacca poi il secondo carbonile e forma un secondo intermedio di reazione.
Sottoponendo questa molecola alla disidratazione si arriva al prodotto di cui stiamo parlando. In alternativa c’è un secondo metodo, ossia la Sintesi di Hantzsch, dove si sfrutta un β-chetoestere e un α-alochetone come molecola di partenza. Lo si sottopone poi al processo di condensazione in presenza di ammoniaca (NH3) o di un’ammina primaria.
In questo secondo processo di sintesi si ottiene prima un’immina, che attraverso tautomerizzazione diventa un’enamnina. Con una reazione di ciclizzazione che chiude il processo si ottiene l’anello pirrolico. Come prodotto secondario è possibile che si formino delle molecole di furano.