Microtubuli: struttura e instabilità dinamica
Tra le strutture cellulari quella che svolge la principale funzione di sostegno è quella formata dei microtubuli. Si tratte di elementi a forma di tubo (dettaglio a cui devono il nome) che attraversano il citoplasma e insieme ad altri elementi formano il citoscheletro. Ne fanno parte anche i microfilamenti e i filamenti intermedi.
I primi sono formati da molecole di actina e si chiamano così perché hanno un diametro di appena 7 nanometri (nm). Sono molto flessibili e hanno un ruolo importante nella divisione cellulare. I filamenti intermedi invece sono formati da diverse proteine e forniscono alla cellula una certa resistenza a sollecitazioni meccaniche come lo stiramento.
La struttura dei microtubuli
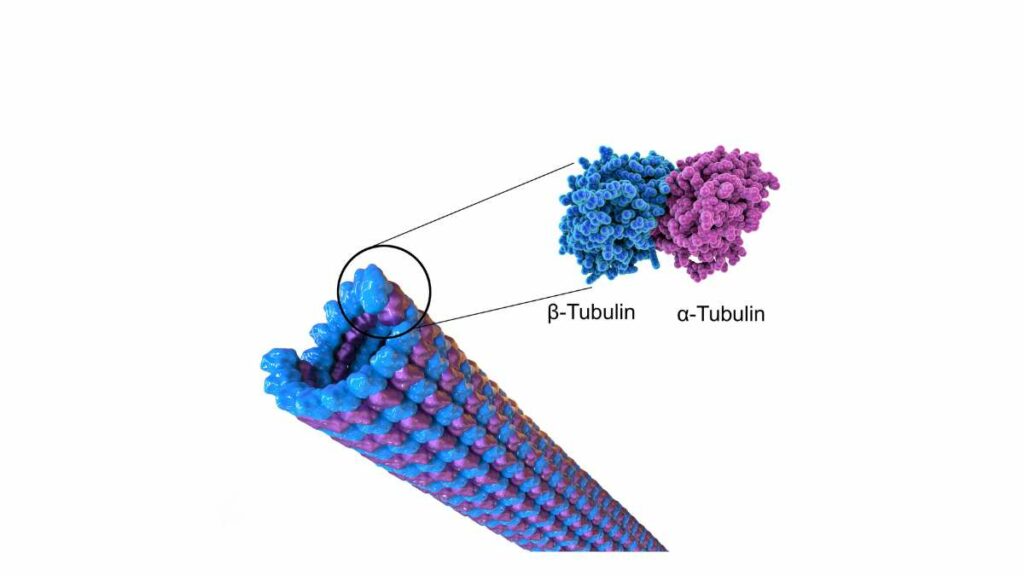
Esaminandoli al microscopio elettronico si mostrano come formati dall’unione di unità di una proteina globulare chiamata tubulina. Questo polimero è a sua volta composto da due subunità monomeriche, che si indicano con le lettere greche α e β. Legandosi l’una all’altra queste due subunità formano un complesso eterodimero. Ognuno di questi complessi ha un peso pari a 15 kDa.
Sia la tubulina α che la tubulina β legano una molecola di GTP (guanosintrifosfato). Quella che si lega alla subunità α tuttavia non viene mai idrolizzata, mentre quella che lega la subunità β può perdere un gruppo fosfato e formare GDP. Grazie al legame con il GTP favorisce la formazione dei protofilamenti che poi si aggregano fra loro a gruppi di 13 formando i microtubuli.
Il diametro della struttura che risulta dall’unione di 13 protofilamenti affiancati è di 25 nm. Ognuno di loro ha polarità intrinseca perché una delle due estremità termina con la subunità α e l’altra con la tubulina β. La prima crea un polo negativo mentre la seconda genera un’estremità con una parziale carica positiva.
All’interno queste strutture presentano un lume, in quanto i protofilamenti si aggregano lasciando una cavità centrale del diametro di circa 10-15 nm. Ogni cellula le disassembla e riassembla in continuazione per adattarsi a diverse condizioni e poter modificare la propria forma in risposta alle sollecitazioni.
Cosa si intende con instabilità dinamica
Come accennato sopra i microtubuli non sono stabili nel senso proprio del termine in quanto non sono strutture fisse. A seconda del momento crescono in lunghezza o si accorciano, nelle fasi definite rispettivamente polimerizzazione e depolimerizzazione. Quando si uniscono a formarli i protofilamenti si avvolgono a spirale con andamento sinistrorso intorno al lume centrale.
Mentre è in fase di polimerizzazione il microtubulo porta una molecola di GTP sulla subunità β, prevenendo la sua idrolisi in GDP che bloccherebbe il processo. Una volta che il GTP si idrolizza infatti si libera energia che porta i protofilamenti a perdere contatto gli uni con gli altri aprendosi verso l’esterno, come pelando una banana. Quest’apertura si propaga in direzione contraria a quella di accrescimento.
Nella cellula possiamo avere strutture in fase di crescita e altre in fase di disassemblaggio in contemporanea a seconda della loro localizzazione. La polimerizzazione può essere interrotta o ripresa di colpo, senza che vi sia mai un tempo di stallo intermedio. Questa instabilità dinamica permette ai microtubuli di spostare la cellula nello spazio e adattarsi rapidamente.
Dato che questo processo libera energia una volta che si idrolizza il GTP possiamo dire che si tratti di un processo che genera lavoro. La forza richiesta è di 4 pN (picoNewton, 10−12 N). Sono sempre le estremità di queste strutture a determinare cosa ne sarà di loro momento per momento.
Le proteine associate ai microtubuli
Per regolare le proprietà dinamiche della tubulina troviamo diversi polipeptidi che interagiscono in modo da determinare il suo allungamento o accorciamento. Come prima proteina regolatrice possiamo nominare la statmina, che è in grado di bloccare gli eterodimeri formati dalle due subunità della tubulina. Impendendone l’assemblaggio la struttura non può continuare ad accrescersi.
Un’altra proteina associata alla tubulina è la catanina, che deve il suo nome alla spada da guerra utilizzata dai samurai. Si tratta di un peptide composto da due subunità, appartenente alla famiglia delle ATPasi. Come si potrà dedurre dall’associazione con il filo affilatissimo della katana, questa proteina è in grado di frammentare i microtubuli. Fu scoperta per la prima volta nei ricci di mare.
Per le sue proprietà la catanina ha un ruolo fondamentale nella regolazione del fuso mitotico e meiotico durante la replicazione cellulare. Agisce durante l’interfase e regola i movimenti delle ciglia nelle cellule che le presentano. Ci sono però altre proteine regolatrici che si trovano alle estremità dei protofilamenti e hanno funzione stabilizzante, come le +TIPs (microtubule plus-end tracking proteins).
Si trovano sulle estremità positive come indica il segno e possono promuovere l’allungamento delle strutture microtubulari. Allo stesso tempo hanno la capacità di stabilizzarle agganciandole alla membrana cellulare. Esistono più di venti diverse +TIPs all’interno delle cellule.