La legge di Hess e il concetto di entalpia nella termodinamica
Tra i principi cardine della termodinamica e della chimica fisica c’è la legge di Hess, formulata dal chimico svizzero Germain Hess nella prima metà del 1800. L’articolo scientifico che riportava questa scoperta risulta infatti pubblicato nel 1840, e oggi la ricordiamo come la versione ancestrale del primo principio della Termodinamica. Per studiarla però occorre comprendere bene il concetto di entalpia.
Quest’ultima è una funzione di stato ed esprime la quantità di energia che un sistema può scambiare con l’ambiente a una pressione determinata. La si indica con il simbolo H, e si può esprimere sia in Joule (J) che in calorie. L’entalpia di un sistema si può ricavare dalla somma dell’energia interna con il prodotto della pressione del volume.
Cosa afferma l’enunciato della legge di Hess
Questo principio si conosce anche come legge della somma delle entalpie e consente di calcolare la variazione dell’entalpia quando non la si può ricavare sperimentalmente. Il suo enunciato afferma quanto segue: la variazione dell’entalpia rimane uguale sia che questa avvenga in un solo stadio che in più passaggi successivi. Questa variazione si indica con il simbolo ΔH.
Volendo si può formulare l’enunciato anche in un modo più semplice e diretto. Vale a dire che in base alla legge di Hess la variazione di entalpia di una reazione chimica non dipende dal percorso che attraversa fra stadio iniziale a stadio finale. Dunque reazioni chimiche che hanno andamenti diversi possono comunque registrare lo stesso ΔH.
Per semplificare il calcolo è possibile misurare questa variazione attraverso la suddivisione del processo chimico in esame in reazioni parziali e quantificare per ciascuna il ΔH. La somma di tutti questi risultati andrà a coincidere con quella complessiva della reazione. Nelle reazioni chimiche di scomposizione il ΔH coincide con il calore che serve per spezzare l’energia dei legami chimici presenti in una mole di sostanza.
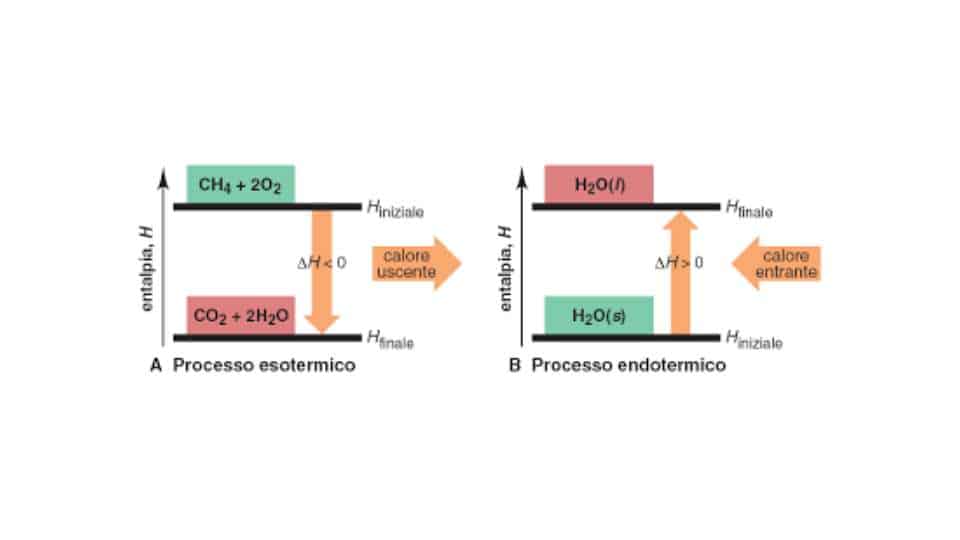
In base al valore che assume la variazione di entalpia possiamo capire se la reazione in esame sia un processo endotermico o esotermico. Infatti se il ΔH è maggiore di zero la reazione libera calore e dunque è esotermica, mentre se è maggiore lo assorbe e la reazione è endotermica.
Come utilizzare nel pratico questo principio
Abbiamo accennato che la legge di Hess torna utile quando non c’è modo di determinare una variazione di entalpia in modo sperimentale. Per usarla prima di tutto occorre determinare quali siano le reazioni chimiche note che possano essere usate per il caso in esame, come reazioni parziali. Bisogna anche verificare che tali reazioni siano bilanciate modificando eventualmente i coefficienti stechiometrici.
Per determinare l’entalpia di una reazione chimica nota ci si basa con i valori standard che si trovano all’interno di database specifici. Sono disponibili infatti i valori dell’entalpia di formazione di varie sostanze in condizioni standard. Per essere più precisi queste condizioni prevedono la pressione pari a 1 bar e temperatura corrispondente a 25°C.
A questo punto a seconda di come si è scomposto il processo chimico in esame si può applicare la legge di Hess facendo gli opportuni calcoli fra le entalpie standard. Quando due reazioni risultano processi sequenziali fra loro allora i valori di entalpie si sommano, Se un processo parziale ne inverte un altro invece la sua entalpia finisce sottratta.
Per esempio considerando il processo di combustione del metano (CH4) lo si può suddividere in due passaggi. Conoscendo le entalpie della combustione del carbonio e dell’idrogeno si possono utilizzare i ΔH di queste due reazioni e sommarle per ottenere quello della reazione descritta.
Esercizio di applicazione della legge di Hess
A disposizione ci sono la reazione che produce cloro molecolare a partire dall’acido cloridrico e quella che ottiene dicloroetano a partire da HCl ed etilene. Nel dettaglio la prima è O2 + HCl → Cl2+ H2O. Va bilanciata, quindi cambiamo i coefficienti stechiometrici e avremo O2 + 4 HCl => 2Cl2+ 2H2O. La seconda invece è C2H4 + O2 + HCl => H2O + C2H4Cl2. Bilanciandola otteniamo C2H4 + 1/2 O2 + 2HCl => H2O + C2H4Cl2.
Il ΔH della reazione che produce il cloro è -202,4 kJ, mentre per la seconda risulta -318,7 kJ. A questo punto notiamo che la prima reazione andrebbe invertita dato che ci serve l’HCl, dunque il segno della sua entalpia diverrà positivo. Nella reazione che stiamo esaminando abbiamo una sola mole di Cl2 quindi divideremo per due il valore del ΔH. Otterremo così 101,2 kJ.
La seconda reazione si può tenere com’è, quindi andremo a sommare il valore della prima reazione capovolta e quello della seconda. Perciò 101,2 – 318,7 = -217,5 kJ.
Cos’è l’entalpia di formazione
Conoscere il valore di ΔH delle reazioni che portano alla sintesi dei composti presenti nella reazione è la base per applicare la legge di Hess. L’entalpia di formazione si indica con il simbolo ΔHf e per le sostanze pure corrisponde alla variazione di entalpia che richiede produrre una mole di tale sostanza.
Una particolarità delle reazioni di formazione è che troviamo spesso delle eccezioni alla legge di Dalton. Sappiamo che questa prevede che i rapporti fra le moli dei reagenti vanno espressi con numeri interi. Tuttavia nella sintesi degli elementi puri troviamo anche coefficienti stechiometrici frazionari.
Per semplificare i calcoli previsti nel caso degli elementi puri nel loro stato standard si assegna entalpia di formazione pari a zero. Questo vale anche per gli elementi puri che si trovano sotto forma di molecole biatomica, come l’azoto (N2).