Legame ionico: panoramica sulla definizione, proprietà e esempi
Tra le interazioni fra atomi che formano le molecole il legame ionico è uno dei principali e più forti, tanto che supera quello covalente. A differenza di quest’ultimo infatti lo spostamento di elettroni avviene in maniera definitiva. In più può avvenire solo tra atomi molto distanti fra loro nella loro posizione all’interno della tavola periodica.
Questa interazione può avvenire non solo fra due atomi singoli ma anche fra gruppi più numerosi. Non va però confuso con il legame metallico che avviene in un oggetto di metallo (ferro, rame, oro) ma solo fra atomi dello stesso elemento. Si tratta di un’attrazione elettrostatica fra nuclei metallici ed elettroni.
Legame ionico: quando può formarsi
La prima condizione necessaria è che gli atomi che prendono parte a questo tipo di legame devono avere una differenza notevole dei loro valori di elettronegatività. Si tratta di una proprietà periodica come il raggio atomico, l’energia di ionizzazione e l’affinità elettronica. Quindi ha un andamento preciso lungo gruppi e periodi della tavola.
Altre caratteristiche che devono possedere gli elementi per essere predisposti al legame ionico sono o una bassa energia di ionizzazione o un’alta affinità elettronica. SI tratta degli elementi dei primi gruppi (primo e secondo) e degli ultimi due escluso quello dei gas nobili. Questo perché i primi cedono facilmente elettroni e i secondi sono portati ad acquistarli.
Per fare un esempio si possono considerare il Fluoro (F) e il Litio (Li), tra cui esiste una differenza di elettronegatività pari a 3 (3,98 il primo e 0.98 il secondo). Rimuovendo un elettrone dal litio diventa uno ione Li+ mentre il fluoro acquistandolo si trasforma nello ione F-. Le cariche opposte si attraggono e così si viene a creare il legame.
Si può quindi affermare che questo tipo di unione ha luogo solo fra ioni di carica opposta. I cationi, ovvero gli atomi che possiedono carica positiva e gli anioni, che invece hanno carica negativa. Esistono anche cationi e anioni poliatomici, come ad esempio lo ione ammonio (NH4+) o lo ione solfato (SO42-).
Differenze con il legame covalente
Entrambi sono legami chimici, ma parte questo hanno poche affinità fra di loro. Il legame ionico come precisato richiede un’alta differenza di elettronegatività fra le parti coinvolte, superiore a 1,9. Fino a questo valore invece i due atomi si possono legare attraverso il legame covalente. Una differenza sostanziale che è bene memorizzare.
Nel legame covalente c’è la condivisione di uno o più doppietti di elettroni, e in base a questo lo si denomina semplice, doppio o triplo. Queste particelle negative diventano parte di entrambi gli atomi coinvolti, ma non è così per quello ionico. Qui c’è un trasferimento di un elettrone fra un atomo e l’altro, non la messa in comune.
Uno degli esempi di legame ionico più noto è il cloruro di sodio (sale da cucina), NaCl. Quando si forma è il sodio a cedere il suo elettrone più esterno trasformandosi nel catione Na+ mentre il Cloro lo acquista diventano un anione Cl-. A questo punto i due ioni si uniscono, anche se possono essere suddivisi mettendo il composto in acqua.
Una similarità fra i due tipi di legame è che ciò che risulta dalla loro unione è più stabile dei due atomi che c’erano all’inizio della reazione. Il fine della formazione dei legami chimici del resto è proprio raggiungere una condizione più equilibrata, come per tutte le trasformazioni chimiche o fisiche.
Come si rappresenta il legame ionico
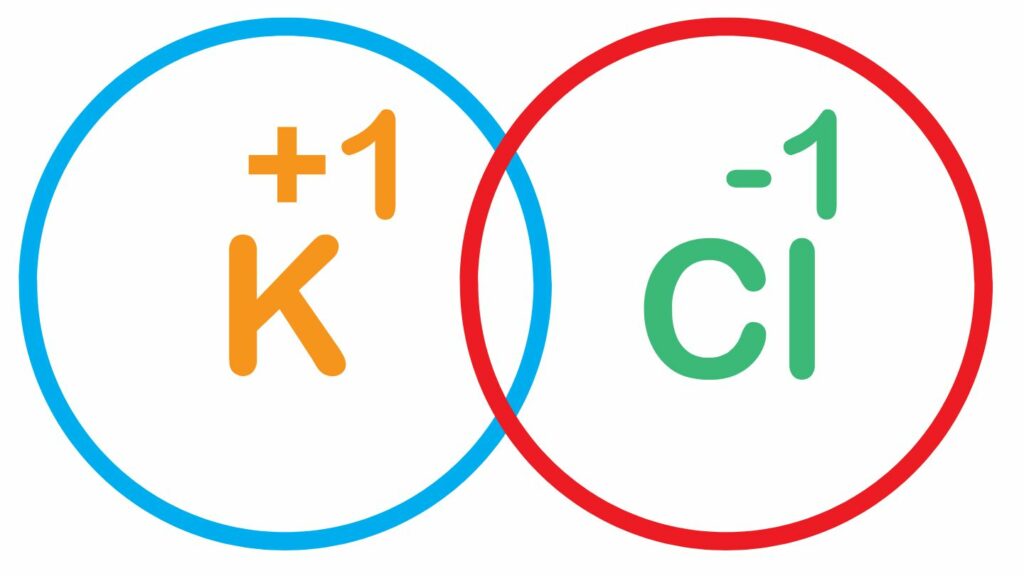
Data la natura di ciò che si ottiene dal legame ionico non si possono usare le strutture di Lewis (quelle in cui gli elettroni sono rappresentati in doppietti attorno al simbolo chimico). Di solito si mettono uno accanto all’altro le sigle degli elementi chimici aggiungendo le cariche. Ad esempio Li+Cl- o Na+Cl-.
Questa modalità di scrittura è molto semplice e può essere usata anche quando si tratta di mettere per iscritto un aggregato poliatomico. Questo però va messo fra parentesi quadre e la carica scritta all’esterno. Questi legami nel pratico danno origine sempre a strutture cristalline con energia reticolare variabile a seconda delle dimensioni degli ioni.
Questa energia si può calcolare con la formula C(Z+)(Z–)/ R0. La C è una costante, Z+ è lo ione positivo e Z–ovviamente quello negativo (sono le loro cariche). Invece R0 è la distanza fra gli ioni, e la sua misura dipende dai loro raggi atomici.