Le interazioni elettrostatiche deboli: il dipolo permanente
Tra le interazioni elettrostatiche deboli che si possono formare c’è il dipolo permanente. Si tratta di una delle tipologie di legame chimico chiamate interazioni dipolo-dipolo, che in tutto sono tre. Sono le forze di Van der Waals che legano le due molecole polari una volta che sono limitrofe. Per natura agiscono solo a corto raggio e dipendono da fluttuazioni delle nubi elettroniche delle particelle.
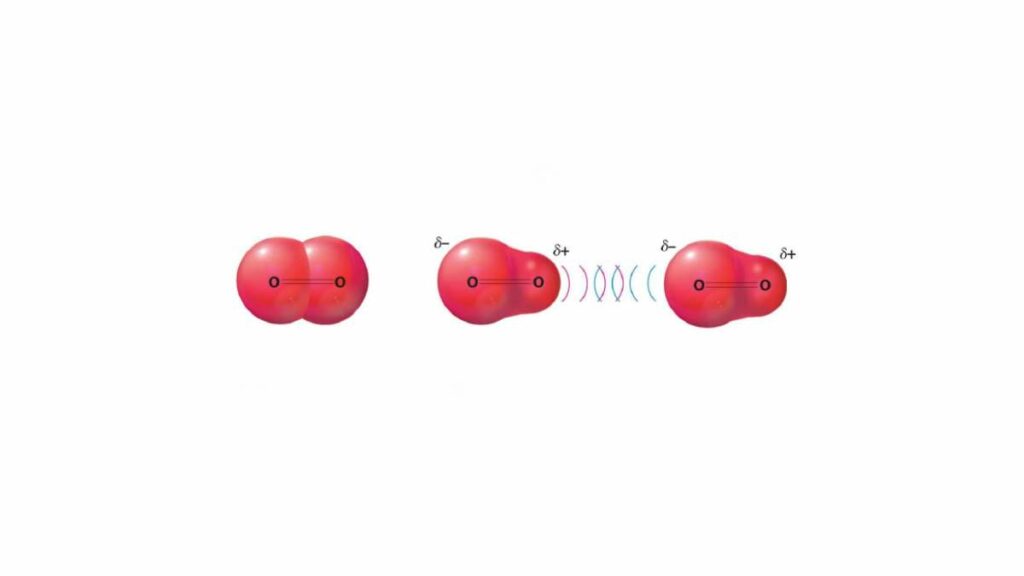
Quando due molecole polari sono vicine fra di loro si dispongono in modo che il polo positivo (δ+) e quello negativo (δ-) risultino uno di fronte all’altro. Ciascuna delle due possiede entrambi i poli, e ruota per disporre quello opposto. Il simbolo δ indica una concentrazione di carica in una zona della molecola, che può essere positiva o negativa.
Cos’è un dipolo permanente
Oltre ai legami chimici che già conosciamo esistono alcuni processi di avvicinamento fra le molecole che non prevedono la condivisione di elettroni. Si tratta delle interazioni dipolo-dipolo, dette così perché si verificano solo fra molecole dipolari, che hanno una ona carica positivamente e una adiacente con carica negativa.
Quando due molecole di questo tipo si trovano vicine l’attrazione elettrostatica che si genera fra i loro poli δ+/δ- le porta ad avvicinarsi. Per farlo però si dispongono in modo che le regioni con carica opposta si vengano a trovare una di fronte all’altra. L’interazione può essere fra un dipolo permanente, indotto o istantaneo e un altro uguale o fra due dipoli con carattere diverso.
Il nostro caso di interesse è il primo citato fra i tre. Come suggerisce il nome si tratta di una condizione in cui la polarità permane nel tempo. Perché questo avvenga serve che uno dei due atomi della molecola abbia una maggiore elettronegatività rispetto all’altro. Per avere un legame covalente polare è necessaria una differenza fra i valori dei due atomi maggiore di 0.4.
Se un atomo è più elettronegativo attrae a sé gli elettroni con una forza maggiore rispetto a quello a cui è legato. Si crea così un’asimmetria nella distribuzione della carica, con l’atomo con elettronegatività più alta che diventa δ- e l’altro che di conseguenza assume una parziale carica positiva δ+. Una condizione che non cambia perché il legame fra i due atomi nasce già così.
La differenza con i dipoli indotti e istantanei
Per comprendere meglio la natura del dipolo permanente possiamo esaminare anche gli altri due casi in cui si creano due poli in una molecola. Quando si dice che questi sono indotti significa che δ- e δ+ si creano in molecole apolari e solo in determinate situazioni. Ovvero quando viene posta vicino a una molecola che ha natura polare.
La forza attrattiva esercitata dal polo positivo verso gli elettroni del composto apolare infatti li porta a concentrarsi su uno degli atomi della molecola. Questa riorganizzazione della nube elettronica porta l’altro atomo a diventare a sua volta un polo con una lieve carica positiva. Finché non si allontanano le due molecole perciò si crea un dipolo indotto perché influenzato da un composto polare.
Per quanto riguarda la differenza fra dipolo permanente e istantaneo, il secondo si definisce tale perché la condizione di polarità ha durata molto breve. Si tratta di fluttuazioni momentanee della nuvola elettronica dovute al moto disordinato degli elettroni fra un atomo e l’altro. Di conseguenza per delle frazioni di secondo una regione vedrà una concentrazione di carica negativa maggiore o minore.
Anche una molecola che assume polarità per brevi periodi tuttavia è in grado di generare un’interazione dipolo-dipolo. Come nel caso di una molecola che ha una polarità fissa, se posta accanto a un composto apolare può riorganizzare la sua nube elettronica. Si parla allora di interazione dipolo istantaneo-dipolo indotto.
Esempi di dipolo permanente
Di conseguenza per esempio tutti gli idruri (idrogeno + metallo) rientrano in questa categoria. Ma lo stesso vale quando l’idrogeno si lega a un non metallo, quindi anche l’acido cloridrico (HCl) è un dipolo permanente, così come l’ammoniaca (NH 3). A questo punto però è necessario un chiarimento, perché i sali binari come il NaCl (cloruro di sodio) non sono considerati tali.
Il motivo è che quando la differenza di elettronegatività fra due atomi supera il valore di 1,9 allora non si forma più un legame covalente ma uno di tipo ionico. Le molecole che si formano per l’associazione di due ioni sono unite da un’interazione elettrostatica molto forte, quindi abbiamo cariche opposte molto forti.
L’intensità delle interazioni dipolo-dipolo
Se abbiamo un composto allo stato gassoso e abbassiamo la temperatura o la pressione però possiamo diminuire lo spazio intermolecolare. I dipoli così possono venire più facilmente in contatto fra di loro, anche perché pure il moto delle molecole rallenta se si raffredda il sistema. L’intensità delle interazioni dipende però dal valore delle cariche oltre che dalla distanza.
Questa grandezza si misura in Debye (D). Per essere precisi, il valore di 1 D è quello di un dipolo che unisce due cariche pari a 10−10 esu che si trovano alla distanza di 1 ångström (Å), ovvero 10−10 m.