Le caratteristiche del meccanismo noto come condensazione di Claisen
Intorno al 1880 un chimico tedesco diede il nome a un meccanismo noto come condensazione di Claisen, che risulta molto simile alla condensazione aldolica. Questo processo coinvolge due molecole organiche, per la precisione due esteri. Si tratta di composti che presentano un carbonio associato con legame doppio a un atomo di ossigeno e singolo a un secondo ossigeno. Un esempio è l’acetato di etile (CH3COOC2H5).
Lo scopritore di questa reazione fu Rainer Ludwig Claisen, prima giurista e poi chimico laureato all’Università di Bonn. Nella sua attività di ricerca si dedicò in particolare ai meccanismi di condensazione dei composti carbonilici e allo sviluppo di uno strumento di distillazione. Quest’ultimo si chiama tubo di Claisen e consiste in un elemento di vetreria da laboratorio che si presenta come un tubo a gomito ascendente.
Il meccanismo della condensazione di Claisen
Perché la reazione avvenga sono necessari esteri che abbiano almeno un idrogeno in posizione alfa. Si parla infatti di α-idrogeni o di idrogeni acidi, in quanto hanno una pKa che si aggira intorno al valore di 25. Il pKa si trova come risultato dell’operazione -logKa e permette di ricavare il grado di acidità degli idrogeni di un composto organico.
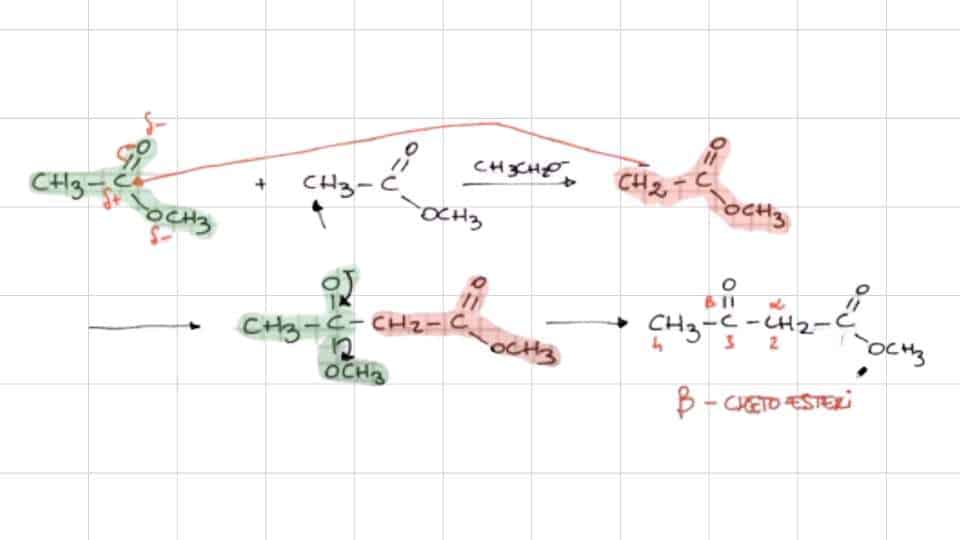
Facendo reagire due molecole di un estere che possiede un α-idrogeno con una base forte come può essere l’idrossido di sodio (NaOH) dà inizio alla condensazione di Claisen. I prodotti di reazione che si ottengono sono un alcol e un β-chetoestere, vale a dire un composto organico con un gruppo chetonico in posizione β. Non è l’unico metodo per ottenerli perché si generano anche da altri processi chimici.
All’inizio della reazione la base estrae un idrogeno dall’estere e produce così uno ione enolato. Questo venendo a contatto con l’altra molecola di estere crea un’addizione nucleofila e si produce un intermedio tetraedrico (alcossido). Da questa struttura si distacca poi lo ione etossido e si crea l’acetato di etile, ovvero il β-chetoestere. La reazione tuttavia non è ancora terminata perché lo ione lo deprotona, agendo come una base.
Si ottengono a questo punto un alcol e una base coniugata della molecola di β-chetoestere. Per riottenere la struttura precedente, dal carattere più acido, c’è bisogno di un acido forte che generi una protonazione. Nella maggior parte dei casi si utilizza a questo scopo l’acido cloridrico (HCl).
Le differenze con la condensazione aldolica
Per quanto risulti simile alla condensazione di Claisen quella aldolica non è del tutto sovrapponibile. Possiamo dire che la differenza principale sta in ciò a cui va incontro l’intermedio tetraedrico che si forma nel corso delle due reazioni. Nel processo esaminato prima infatti questo espelle uno ione etossido, mentre nel processo aldolico l’intermedio è protonato e produce un aldolo.
Si tratta di un composto chimico che nella propria molecola contiene un gruppo ossidrile (-OH) e un gruppo carbonile (C=O). Possiamo inquadrare meglio la condensazione aldolica come un meccanismo in cui reagiscono uno ione enolato e un composto carbonilico. Serve poi la presenza di una sostanza che trasferisca un protone all’alcossido che si genera dalla reazione precedente.
La sostanza in questione in questi processo può essere l’acqua oppure l’etanolo (C2H6O). La protonazione produce oltre all’aldolo uno ione idrossido (-OH), che funge anche da catalizzatore nel primo passaggio del meccanismo e così si rigenera. Anche nella condensazione di Claisen avevamo osservato la necessità della presenza di una base.
L’aldolo che si ottiene se riscaldato si disidrata facilmente. In alcuni casi la reazione di condensazione può avvenire in forma intramolecolare, per esempio se si ha un composto ciclico dicarbonilico. L’equilibrio, quando questo processo coinvolge le aldeidi, è fortemente spostato verso la formazione degli aldoli e quindi verso destra.
Come avviene la condensazione di Claisen incrociata
La reazione esaminata prima osservava reagire due molecole dello stesso estere enolizzabile. Quando però a essere coinvolte sono due molecole diverse fra di loro allora abbiamo un meccanismo dove la denominazione varia aggiungendo “incrociata” alla denominazione. uno dei due esteri come prima è enolizzabile in quanto possiede un idrogeno acido, mentre l’altro non lo ha e quindi si classifica come non enolizzabile.
Esempi di esteri non enolizzabili spesso usati per la condensazione di Claisen incrociata sono l’ossalato di alchile e il benzoato di alchile. Anche in questo caso è necessaria la presenza di una base forte e produce composti β-dicarbonilici. Per essere precisi si otterrebbe una miscela di quattro prodotti diversi, non facili da isolare fra di loro, ma grazie all’estere non enolizzabile se ne ottiene invece uno solo.
La presenza della base riesce a formare un legame C-C- tra il carbonio carbonilico di un estere e il carbonio α dell’altro. La presenza dell’estere senza idrogeni acidi serve anche a evitare la reazione di autocondensazione di quello enolizzabile. Per garantire che questa non proceda però serve utilizzarne un eccesso rispetto all’altra sostanza.
Gli utilizzi dei β-chetoesteri
Abbiamo detto che dalla condensazione di Claisen si ottengono composti chiamati β-chetoesteri. Si tratta di molecole che reagiscono facilmente con gli alogenuri alchilici, ovvero composti organici che hanno come formula generale CnH2n+1−X. L’atomo indicato con X può essere uno qualsiasi degli alogenuri, ovvero gli elementi fluoro (F), cloro (Cl), bromo (Br) e iodio (I).
Dalla reazione fra un β-chetoestere e un alogenuro alchilico si ottengono composti chiamati β-chetoesteri monoalchilati, poi dialchilati. Il meccanismo con cui avviene la reazione è SN2 (sostituzione nucleofila bimolecolare), ovvero un processo dove un legame si rompe e un altro si forma in maniera sincrona.
Da queste ultime molecole si possono ottenere tramite idrolisi i β-chetoacidi, ovvero acidi carbossilici con un gruppo carbonilico in posizione β. In questo gruppo di composti rientra il Malonil-CoA, fondamentale per la sintesi degli acidi grassi. I β-chetoacidi si possono decarbossilare a temperatura ambiente formando un chetone e anidride carbonica.