Condensazione aldolica in chimica organica
Tra i diversi meccanismi di condensazione che possono avvenire in Chimica Organica troviamo la condensazione aldolica. Risulta simile alla condensazione di Claisen, che però coinvolge molecole di estere che hanno un idrogeno acido (in posizione alfa).
Il processo che andremo a studiare invece prevede come reagenti aldeidi e chetoni. Vale a dire composti con formule generali rispettivamente R−CHO e R-CO-R’.
Il prodotto di questa reazione, che prevede l’eliminazione di una molecola d’acqua, è un composto denominato aldolo. Nella sia struttura molecolare sono presenti un grubbo carbonile (C=O) e un gruppo ossidrile (OH). A volte li si indica anche con il nome di 𝛽-idrossicarbonile, che può essere sia una 𝛽-idrossialdeide che un 𝛽-idrossichetone.
Come procede la reazione di condensazione aldolica
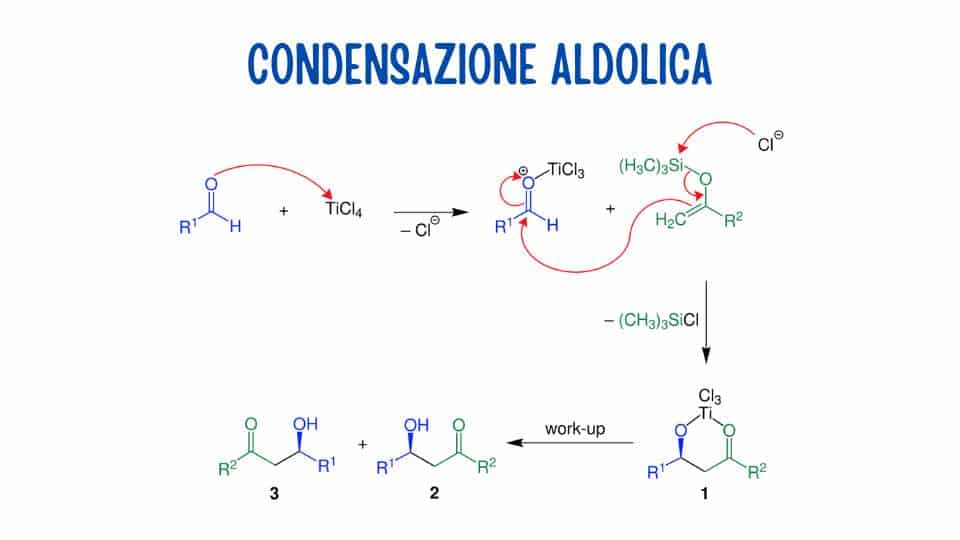
Il processo si articola in tre fasi, ma per avviarsi ha bisogno di un ambiente alcalino diluito, ovvero della presenza di una base debole o diluita. Di solito si ricorre a idrossido di sodio (NaOH) diluito in acqua. Questo ambiente alcalino fornisce gli ioni idrossido necessari per la prima fase della reazione, dove un OH- strappa un idrogeno alla molecola di aldeide formando un carbanione stabile per risonanza.
L’eccesso di elettroni rimasto su uno dei carboni dopo la rimozione di un H+ porta infatti a un riarrangiamento degli elettroni e della perdita del doppio legame fra carbonio e ossigeno. Il carbanione creato si chiama anche ione enolato, e quando si crea si procede con la seconda fase della condensazione aldolica. In questo passaggio il carbanione effettua un attacco nucleofila al gruppo carbonilico di un’altra molecola di aldeide.
Lo ione enolato è un’anione, quindi possiede carica negativa. L’attacco nucleofilo genera un intermedio di reazione stabile che presenta sempre una parziale carica negativa su un atomo di ossigeno, chiamato ione alcossido. Questo ione poi riceve il trasferimento di un atomo di idrogeno dal solvente in cui ci si svolge la reazione, di solito acqua o etanolo.
L’aggiunta dell’idrogeno neutralizza la carica negativa dello ione alcossido è il terzo e ultimo passaggio della reazione. Al termine di questa fase si ottiene così il prodotto finale, l’aldolo. Possiamo dire che in questa reazione lo ione idrossido svolge la funzione di catalizzatore, facilitando perciò la produzione dell’aldolo. Questo composto si può disidratare ricavando un’aldeide α, β-insatura.
La reattività della molecola di aldolo/chetolo
La reazione di condensazione aldolica non è un processo irreversibile quindi è possibile riottenere l’aldeide o il chetone di partenza.
L’equilibrio di reazione tuttavia spostato verso destra, quindi favorisce la formazione degli aldoli. Questo vale almeno nel caso in cui a reagire sia un’aldeide. Infatti se è quando è un chetone ad andare incontro a condensazione l’equilibrio è più spostato verso sinistra che non verso la formazione del chetolo.
Abbiamo accennato che disidratando un aldolo si ottiene un’aldeide α, β-insatura, che poi rappresenta il composto insaturo coniugato. L’aldolo di per sé infatti risulta instabile e perde facilmente una molecola d’acqua se posto in un ambiente basico. Lo si sfrutta spesso come intermedio di reazione per poi usare la sua capacità di formare legami C-C e costruire molecole più complesse.
Se per i prodotti della condensazione aldolica serve un ambiente acido per favorire la disidratazione, se abbiamo di fronte un chetolo funziona diversamente. Per far perdere a un 𝛽-idrossichetone una molecola d’acqua è necessario porlo in ambiente acido. A seconda del chetolo possiamo avere una reazione di eliminazione dell’H2O di tipo E1 o E2.
Nel caso del meccanismo E1 si avrà un’eliminazione di tipo unimolecolare, mentre le reazioni E2 prevendono un’eliminazione bimolecolare. Alcuni aldoli li possiamo trovare impiegati all’interno dell’industria agroalimentare come aromi.
La condensazione aldolica incrociata
Questo risultato è legato alla condizione in cui una delle due aldeidi assume natura elettrofila e l’altra neutrofila. Due di questi composti deriveranno per l’appunto dal processo della condensazione aldolica incrociata, mentre gli altri due prodotti derivano da un’autoaddizione. Ognuno dei reagenti è infatti di effettuare una condensazione con sé stesso.
Per evitare la formazione della miscela descritta sopra si può provare a ricorrere a composti che presentino determinate caratteristiche. Uno dei due non deve avere idrogeni in alfa e il secondo deve risultare poco reattivo per evitare di andare incontro ad autocondensazione. Un composto carbonilico che difficilmente va incontro a questa reazione per esempio è l’acetone, anche per questione di ingombro sterico.
La condensazione mista si effettua spesso anche utilizzando come reagenti delle aldeidi aromatiche, che possiedono almeno un anello benzenico. Per esempio la benzaldeide e la 2-furaldeide. La benzaldeide è considerata come la molecola più semplice nel gruppo delle aldeidi aromatiche e ha formula bruta C7H6O.