Pila di Daniell e celle galvaniche: come funzionano
Quando si parla di celle galvaniche non si può non considerare la pila Daniell, considerata l’evoluzione di quella progettata da Alessandro Volta. Quella realizzata dal chimico italiano infatti fu in assoluto il primo generatore statico di energia elettrica, che oggi si trova conservato all’Università di Pavia. Si basava sugli studi di Luigi Galvani come quella di Daniell, che però rese il dispositivo più sicuro ed efficiente.
Per capire il principio di funzionamento della pila bisogna partire dalle reazioni di ossido-riduzione che si svolgono nelle celle galvaniche. Esse producono energia chimica di legame che poi si converte in elettrica, l’inverno di quanto avviene nelle celle di elettrolisi.
Come si costruisce una pila Daniell
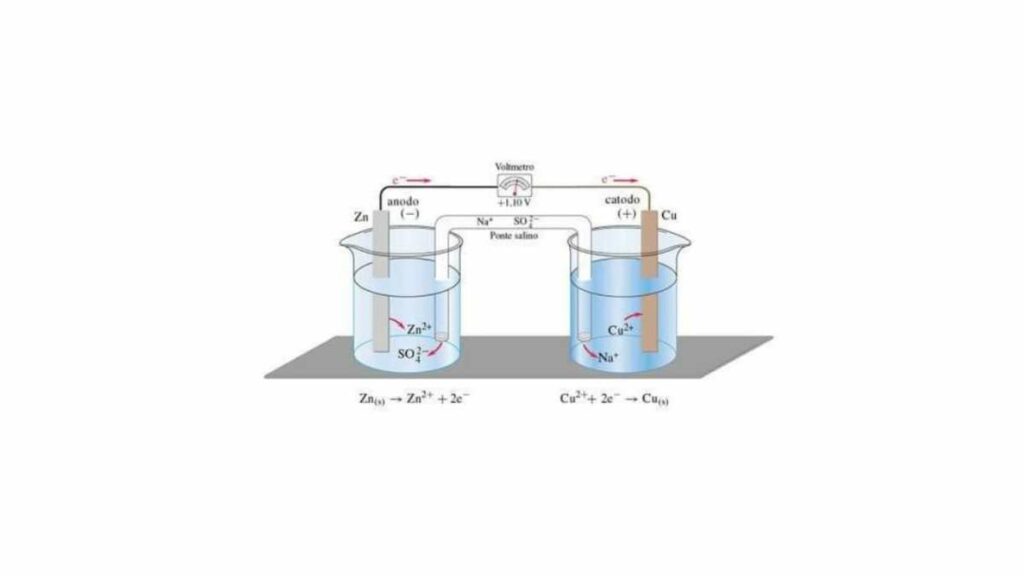
Realizzare questo piccolo generatore inventato nel 1836 non è complesso una volta reperiti i materiali. Occorre avere a disposizione due becker o comunque due contenitori di vetro uguali, in cui andranno inserite due soluzioni, ciascuna con concentrazione 1 M. In un becker del solfato di rame (CuSO4) mentre nell’altro del solfato di zinco (ZnSO4).
Nel becker in cui si sarà versata la soluzione di ZnSO4 si immergerà una barretta di zinco, in quello con il CuSO4 un’altra barretta, ma di rame. A questo punto servirà un tubo a ponte, con due estremità che possano immergersi nelle due soluzioni e che al suo interno contenga nitrato di potassio (KNO3) in soluzione satura. A questo punto basta procurarsi un amperometro per completare la pila di Daniell.
Una volta che lo strumento risulta collegato alle due soluzioni con due fili conduttori (anodo e catodo) si possono innescare le reazioni. Ognuno dei becker infatti rappresenta una semicella galvanica e si verificano rispettivamente un’ossidazione dello zinco (Zn2+) e una riduzione del rame (Cu2+ + 2e–). Dunque il polo negativo è il becker con il solfato di zinco e quello positivo quello con il solfato di rame.
La funzione del ponte salino è quella di neutralizzare le cariche che si accumulano all’intero delle semicelle. Il nitrato di potassio infatti si dissocia negli ioni NO3– e K+ che neutralizzano l’uno le cariche positive che si formano all’anodo, e il secondo le cariche negative presenti al catodo. L’amperometro registra la corrente che si genera.
Differenze fra celle galvaniche ed elettrolitiche
Le celle della pila di Daniell sono della prima tipologia, ossia creano un passaggio di corrente in seguito a una reazione chimica spontanea. La reazione redox che si verifica riassumendo quanto detto prima è Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s). Per quanto riguarda invece le celle elettrolitiche il loro funzionamento si basa sul principio inverso, ossia sfruttare la corrente per favorire un processo chimico.
Dato che c’è bisogno di fornire energia elettrica per farla procedere, la reazione che avviene all’interno di una cella elettrolitica non è spontanea. Per realizzarne uno è necessario un recipiente chiuso che contenga l’elettrolita in soluzione dove si trovano immersi due elettrodi. Entrambi risultano collegati a un generatore di corrente continua.
Come si nota dunque a differenza della pila di Daniell è presente un solo comparto che contiene entrambi i poli e non due celle separate. Sono i due elettrodi a provocare la migrazione degli ioni che costituiscono l’elettrolita per mezzo del passaggio della corrente elettrica. I cationi si spostano sul polo negativo e gli anioni su quello positivo. Un esempio classico è costituito dall’elettrolisi dell’acqua.
A livello industriale le celle elettrolitiche trovano largo impiego nella galvanostegia. Si tratta di un processo con cui tramite immersione si ricopre un oggetto con un sottile strato di metallo. Lo spessore della copertura che si realizza può variare da 1 a circa 10 µm e alcuni esempi sono l’argentatura, la cadmiatura e la doratura.
Pila di Daniell e pila di Volta a confronto
Ogni elemento o unità è composto da due parti discoidali, una di rame e una di zinco. Tra di loro le unità presentano un ulteriore disco di materiale isolante che le separa, in genere o cartone o feltro. Questi vengono imbevuti utilizzando una soluzione elettrolitica, di solito composta da acqua acidula. Le due estremità del cilindro però, come le barrette dei due becker, saranno una di rame e una zinco.
Collegando con un filo conduttore questi due punti si ottiene così un circuito elettrico grazie alla differenza di potenziale stabilita. La pila di Daniell come possiamo già notare utilizza sempre zinco, rame e soluzione salina per la parte neutra, ma è molto più sicura di quella di Volta. Risulta infatti meno pericolosa da maneggiare e più stabile da utilizzare.
Un esperimento facile da fare che richiama la pila di Volta prevede di utilizzare due lamine (zinco e rame) e un limone da schiacciare leggermente. Infilzando il frutto con le due lamine e collegando con due morsetti le lamine a un tester si noterà una tensione pari a 1 Volt.