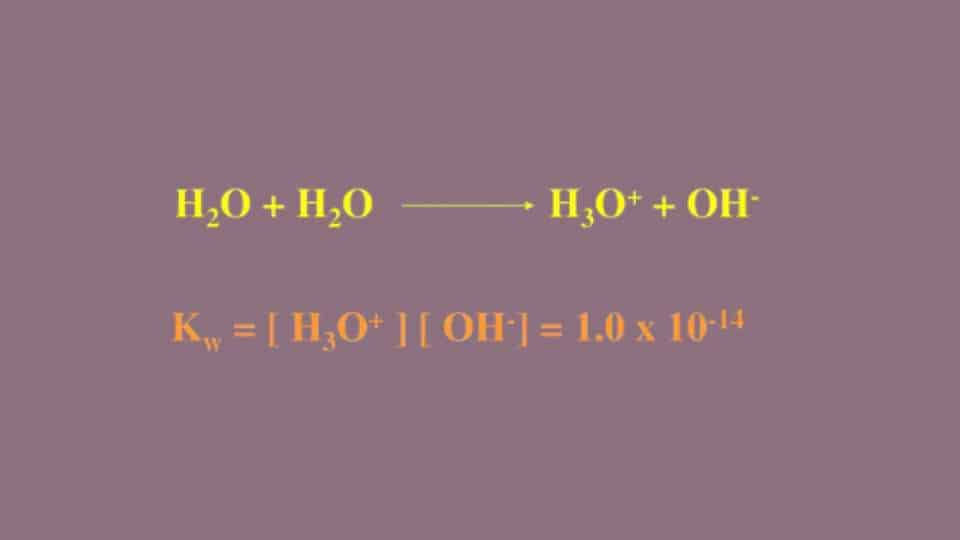Autoprotolisi dell'acqua: come funziona
Per capire bene cosa sono acidi e basi è necessario approfondire l’autoprotolisi dell’acqua, un processo definito anche autoionizzazione. Si tratta di una reazione che coinvolge due molecole di H2O, dove una agisce come acido e una come base. In quanto sostanza anfotera infatti l’acqua può essere entrambi a seconda del composto con cui viene a contatto.
Dalla reazione fra queste due molecole si ottengono due specie ioniche con una carica debole. Questo processo spiega il fatto che l’acqua possieda una lieve conducibilità elettrica, persino quando è pura ovvero senza sali minerali disciolti. Per l’acqua demineralizzata la conducibilità ha un valore pari a 0.055 micro-Siemens/cm alla temperatura di 25°C.
La reazione di autoprotolisi dell’acqua
Se sciogliamo in acqua una sostanza acida come l’acido iodidrico (HI) otteniamo la reazione di ionizzazione HI + H2O <=> H3O⁺ + Cl-. Con una base invece, come l’ammoniaca, la reazione procede nella forma NH3 + H2O <=> OH- + NH4+. Tuttavia anche senza aggiungere un soluto acido o basico si verifica una ionizzazione, dove i reagenti sono due molecole di H2O.
Possiamo dunque scrivere l’autoprotolisi dell’acqua nella forma seguente, ossia H2O + H2O <=> H3O⁺ + OH-. Per calcolare la costante di equilibrio di questa reazione usiamo la stessa formula della Keq delle reazioni. Le concentrazioni dei reagenti le indichiamo con [H2O] e quelle dei prodotti con [H3O⁺ ] e [OH-]. La formula della Kw quindi è [H3O⁺ ] [OH-]/[H2O]2.
A una temperatura di 25°C il valore di questa costane è bassissimo, appena 3,25 · 10-18. Questo significa che l’equilibrio è spostato in modo evidente a sinistra, e perciò il denominatore [H2O]2 si può considerare costante, invariato nel corso della reazione. Perciò possiamo riscrivere la formula nella forma Keq * [H2O]2 =[H3O⁺ ] * [OH-].
Unendo il prodotto Keq * [H2O]2 in un simbolo solo possiamo sostituirgli Kw, Possiamo definire questi simbolo come prodotto ionico dell’acqua perché per calcolarlo dobbiamo usare il prodotto fra [H3O⁺ ] e [OH-]. Sempre a 25°C il valore di Kw è superiore alla Keq ed è pari a 1,00 · 10-14.
Il calcolo del pH e del pOH
Considerando che i due fattori [H3O⁺ ] e [OH-] sono uguali fra di loro possiamo ricavare che entrambe valgono 1 x 10-7 M. Se facciamo il logaritmo negativo della concentrazione di H3O⁺ otteniamo il pH, mentre se facciamo quello della concentrazione di OH- troviamo il pOH. Come possiamo capire vedendoli nella formula dell’autoprotolisi dell’acqua sono valori legati fra loro.
Nel caso dell’acqua sia il pH che il pOH sono uguali a 7, e sommati per qualsiasi soluzione danno sempre 14, che è il valore massimo per entrambi. Conoscendo il pH o il pOH è facile trovare la sua controparte perché è sufficiente sottrarre il suo valore a 14. Il valore 7, che per l’acqua demineralizzata corrisponde sia al pH che al pOH, significa neutralità.
Se invece abbiamo la concentrazione di H3O⁺ risulta superiore a quella degli ioni OH-, cioè [H3O⁺ ] > [OH-] allora abbiamo un ambiente acido. Di conseguenza il pOH sia alza e quello del pH si abbassa. Al contrario se abbiamo [OH-] > [H3O⁺ ] abbiamo una soluzione basica, e il valore del pOH si avvicinerà a 1 mentre quello del pH si alzerà.
Per il pH e il pOH basta questa relazione. Se invece vogliamo le concentrazioni degli ioni possiamo calcolare [H3O⁺] usando la formula inversa Kw/[OH-] e trovare il valore di [OH-] facendo invece Kw/[H3O⁺]. Per esempio se sappiamo che [H3O⁺] = 2,1 x 10-6 allora [OH-] = 1 x 10-14/2,1 x 10-6 = 4,76 x 10-9.
Il carattere anfotero dell’acqua
Se lo sciogliamo in una soluzione con pH acido infatti questa molecola darà luogo alla reazione ZnO + H3O⁺ <=> Zn2+ + 3H2O. Qualora invece lo inseriamo in un ambiente basico, dove sono presenti ioni OH-, si comporta come una sostanza acida abbassandone la concentrazione. Per esempio nella reazione ZnO + NaOH + H2O <=> Na22+[Zn(OH)4]2-.
Si tratta di un effetto che permette di separare dei cationi, e che torna perciò utile in alcuni processi chimici, mentre l’autoprotolisi dell’acqua è più importante come concetto. Ci sono anche altri ossidi che hanno carattere anfotero, come l’ossido piomboso (PbO) e l’ossido di alluminio (Al2O3). E nonostante convenzionalmente gli idrossidi siano inseriti fra le basi anche alcuni di essi possono rivelare carattere anfotero.
Uno di questi è l’idrossido di alluminio, ossia Al(OH)3. Per esempio in una soluzione con l’acido cloridrico dà luogo alla reazione Al(OH)3 + 3HCl <=> AlCl3 + 3H2O. Qui si comporta da base, come ci si aspetterebbe, ma se mischiato con una base come l’NaOH si comporta come un acido.