Le caratteristiche delle ammine in chimica organica
Oltre ai composti formati da carbonio, idrogeno e ossigeno in Chimica Organica troviamo anche molecole come le ammine, che contengono anche l’azoto (N). Si tratta di derivati dell’ammoniaca (NH3) dove al posto di uno o più idrogeni si inseriscono uno o più gruppi alchilici, che possiamo rappresentare con -R. Può trattarsi anche di arili, come ad esempio il fenile (derivato dal benzene).
In base alla tipologia di residui che si vanno a sostituire agli idrogeni dell’ammoniaca possiamo classificare questi composti in più categorie. Conservano però la geometria strutturale dell’NH3, che si presenta come una molecola di forma tetraedrica, con angoli di legame di ampiezza pari a 109,28°. A differenza del carbonio l’azoto forma tre legami covalenti.
La classificazione delle ammine
Per prima cosa distinguiamo tra i derivati dell’ammoniaca di natura alifatica e quelle di natura aromatica. Le prime legato all’atomo di azoto in sostituzione all’atomo di idrogeno esclusivamente dei gruppi alchilici. Nel caso delle molecole aromatiche invece tra i residui troviamo almeno una catena aromatica (senza escludere altri gruppi alchilici).
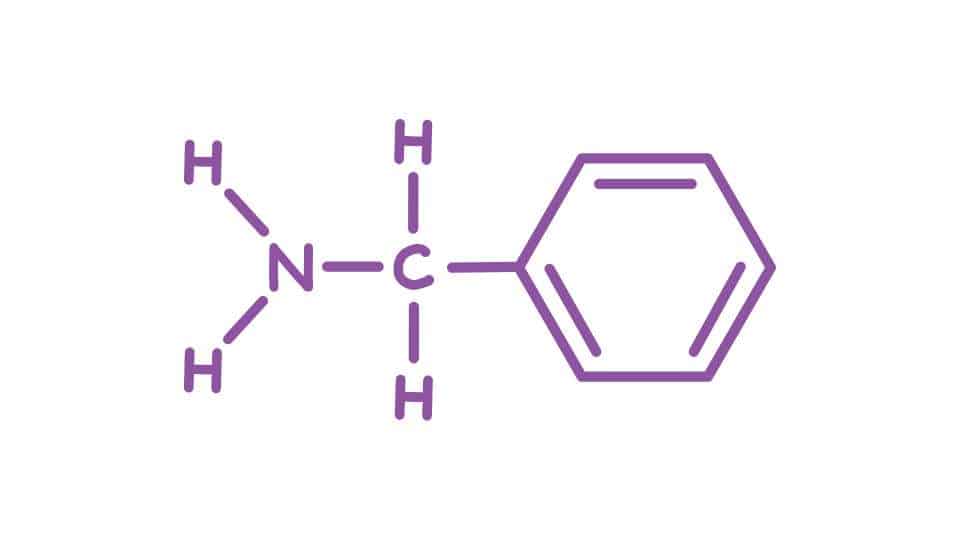
In base al numero di residui che vanno a legarsi all’atomo di azoto invece possiamo distinguere tre categorie di ammine: primarie, secondarie e terziarie. Le prime hanno come formula generale RNH2, in quanto hanno un solo residuo e due idrogeni che rimangono. Un esempio può essere l’etilammina, dove abbiamo legato solo il gruppo CH3CH2.
Nel caso delle secondarie i residui sono due (R2NH) e per le terziarie abbiamo tre residui legati e nessun idrogeno (R3N). Nella nomenclatura IUPAC per assegnare un nome ai composti si elencano in ordine di priorità i sostituenti alchilici e usando il suffisso -ammina. Quando all’azoto sono legati residui aromatici li si considera derivati dell’anilina, detta anche amminobenzene o fenilammina.
Si tratta di un composto che presenta un anello benzilico con legato il gruppo NH2, e che presenta formula bruta C6H7N. Troviamo poi le ammine eterocicliche, dove è presente un anello composto da atomi di carbonio e almeno uno di azoto (eterociclico). I più noti sono la pirrolidina (formula C4H9N), un’ammina alifatica, e la piridina, un composto aromatico.
Le proprietà fisiche e chimiche
Abbiamo già descritto la geometria molecolare delle ammine, dove si presenta anche un’ibridazione degli orbitali di tipo sp3. In quanto derivati dell’ammoniaca a livello organolettico questi composti, in particolare quelli più semplici, hanno un odore poco gradevole. Le più semplici sono facilmente solubili in acqua, e la solubilità diminuisce alla lunghezza dei gruppi alchilici legati.
Nel caso delle molecole con uno o due residui legati il comportamento in acqua è simile a quello degli alcoli, per quelle con tre residui invece possiamo assimilarli agli eteri. Pur se noto che l’ammoniaca è una base debole, i suoi derivati risultano invece avere una basicità superiore, dovuta soprattutto alla presenza degli atomi di carbonio dei residui.
In acqua assistiamo a un sequestro di uno ione idrogeno dall’acqua che si lega al gruppo NH2 e produce uno ione idrossido (OH-). Tuttavia un’amina che possiede residui aromatici è una base più debole di una alifatica. Per quantificare la basicità di queste molecole ci si può basare sul valore di pKa dei loro acidi coniugati. Più basso il valore più forte risulterà l’acido.
Passando al punto di ebollizione quello delle ammine questo risulta superiore rispetto a composti organici di pari massa ma struttura diversa. La presenza dei legami idrogeno fra l’azoto e i residui sono stabili e difficili da rompere, anche se non resistenti quanto quelli che formano gli alcoli con i gruppi -OH.
I metodi di sintesi delle ammine
Per produrre questi composti organici si può partire da degli alogenuri alchilici e sottoporli a una reazione definita sintesi di Gabriel. Questo processo consente di ricavare ammine primarie e prende il nome dallo scienziato Siegmund Gabriel. Per farla occorre prima di tutto ricavare del potassioftalmide, che si ottiene facendo reagire ftalmide con idrossido di potassio (KOH).
Questo composto messo a reagire con un alogenuro alchilico (R-X) produce un N-alchilaftilammide: il gruppo alchilico si lega all’azoto mentre l’alogeno si distacca in forma ionica. La molecola ottenuta, detta anche immide, se fatta reagire con l’idrazina produce un’ammina primaria e la ftalidrazite. Usare la sintesi di Gabriel evita la formazione di ammine secondarie e terziarie.
Un altro sistema impiega dei composti chiamati azidi, caratterizzati per il gruppo funzionale -N3. Utilizzando degli agenti riducenti è possibile ricavarne dei composti di formula RNH2. Si utilizzano a questo scopo per esempio l’idruro di litio alluminio, che ha formula LiAlH4. Per riduzione possiamo ricavare un’ammina anche sfruttando una molecola di nitrile.
I nitrili sono composti organici dove abbiamo una catena di carboni dove uno degli atomi forma un legame triplo con l’azoto. Anche per ridurre questi composti si utilizza come agente riducente il LiAlH4, molto usato anche nei processi di riduzione degli esteri e degli acidi carbossilici. In alternativa è possibile la riduzione catalitica con nichel Raney e in presenza di ammoniaca.